
科目: 来源: 题型:
【题目】在①![]() Li 、②
Li 、②![]() N 、③
N 、③![]() Na 、④
Na 、④![]() Mg 、⑤
Mg 、⑤![]() Li 、⑥
Li 、⑥![]() C 、⑦C60 、⑧石墨中,
C 、⑦C60 、⑧石墨中,
选择序号填空。
(1) 和 质量数相等,但不能互称同位素;
(2) 和 的中子数相等,但质子数不相等,所以不是同一种元素;
(3) 和 互为同素异形体。
(4)________和______互为同位素。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯的同系物是人类最早认识的芳香族化合物,其中对二甲苯(英文名称p—xylene,缩写为PX)是化学工业的重要原料。
已知: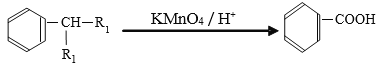
(1)写出PX的结构简式______________。
(2)PX可能发生的反应有__________、_____________。(填反应类型,只填两种。)
(3)有机物M存在如下图所示的转化关系,其中A 是PX的一种同分异构体。

已知:M的分子式为C16H22O4,D能发生银镜反应。
①B的苯环上存在3 种不同化学环境的氢原子,则B 的结构简式是__________。
②D分子中所含的官能团是______________(填化学式)。
③M的结构简式是_______________。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的对位二取代物; b.遇FeCl3溶液显示紫色; c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常常利用物质的酸碱性分离混合物.某一混合物含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如图。

已知:①苯胺(![]() )有弱碱性,可与盐酸等反应生成盐;
)有弱碱性,可与盐酸等反应生成盐;
②常温下,苯胺、苯酚、苯甲酸、苯甲醇微溶于水,但均易溶于有机溶剂。
回答下列问题:
(1)写名称:物质2是 ,物质4是 。
(2)写出A、C的化学式:A , C 。
(3)写出反应②的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数。下列说法正确的是( )
A.22.4L乙烷中含有的共价键数为7 NA个
B.丙烯和环丙烷组成的42g混合气体中氢原子的个数为6 NA
C.0.1mol苯中含有碳碳双键的数目为0.3NA
D.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
查看答案和解析>>
科目: 来源: 题型:
【题目】碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。写出该反应的化学方程式 。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是_____________ _ ______。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2 + Hg=Cu2HgI4(玫瑰红)+ 2Cu,产物Cu2HgI4中Cu元素显____价。当有1 molCu2I2参与反应时,转移电子____mol。
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作。试剂M和操作N的组合正确的是_____(选填编号)

查看答案和解析>>
科目: 来源: 题型:
【题目】CH4、NH3、H2O和HF均为含10e﹣的分子。
(1)N、O、F三种元素中,与基态C原子的核外未成对电子数相等的元素是 (写元素名称),其基态原子的价层电子排布图为 。
(2)C、N、O、F四种元素第一电离能由大到小的顺序是 (用元素符号表示)。
(3)CH4、NH3和H2O分子中,从原子轨道的重叠方向来说,三种分子均含共价键类型为 ,三种分子的中心原子的杂化轨道类型均为 。
(4)CH4燃烧生成CO、CO2和H2O。
①在CO气流中轻微加热金属镍(Ni),生成无色挥发性液态Ni(CO)4,试推测四羰基镍的晶体类型为 。
②OCN﹣与CO2互为等电子体,则OCN—结构式为 。
(5)与碳同族的硅形成的硅酸盐结构中的基本结构单元为[SiO4]四面体,由两个结构单元通过共用一个原子形成的硅酸盐阴离子的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据及装置示意图如图表: ![]()
物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |

实验步骤如下:
Ⅰ.在三口烧瓶中加入16mL 50%的硝酸(密度为l.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V.粗产品经提纯后称重为5.7g
请回答下列问题:
(1)本实验所用50%的HNO3溶液物质的量浓度为 (保留一位小数),滴液漏斗中的细支管a作用是 。
(2)仪器b的名称为 ,其作用是 ,使用时要从 (填“上口”或“下口”)通入冷水。
(3)NaOH溶液的作用是 。溶液上方倒扣的漏斗的作用是 。
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是 。
(5)为了除去可能的杂质和减少产品损失,可分别用 和 洗涤晶体。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放
B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
C.为了有效的发展清洁能源,采用电解水的方法大量制备H2
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体
II.浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海水加工的示意图,根据下图回答问题。

(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。

(3)制备金属镁是通过电解熔融的MgC12,而不用MgO,其原因是 。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是 。
(5)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3SiCl4(g)+2H2(g)+Si(g)![]() 4SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L。若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为 kg。
4SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L。若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为 kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:

(1)① 反应II的化学方程式是______。
② 反应II其中一步反应为2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJmol-1
已知:![]()
![]()
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为_______ kJ。
(2)反应III是利用右图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3 +3H2↑。
NCl3 +3H2↑。

① b接电源的_______极(填“正”或“负”)。
② 阳极反应式是_______。
(3)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。

(1)上表中与A属于同一周期的元素是 (填元素名称);写出B的单质的电子式 。
(2)D和B形成的化合物的化学式为 。
写出A单质与水反应的离子方程式 。
(3)对B、C的单质或化合物描述正确的是 。
a.C元素的最高正价为+7 b.常温、常压下C单质性质稳定
c.B的氧化物只有两种 d.C单质分子中含有18个电子
(4)从海水中提取D的单质可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④ 电解得到产物。以上提取D的单质的过程中,没有涉及的化学反应类型是
a.分解反应 b.化合反应 c.复分解反应 d.置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com