
科目: 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-).下列说法正确的是
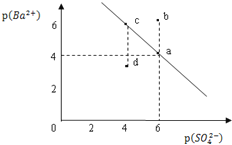
A. 该温度下,Ksp(BaSO4)=1.0×10-24
B. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C. d点表示的是该温度下BaSO4的不饱和溶液
D. 加入BaCl2可以使溶液由c点变到a点
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)H2S和H2Se的参数对比见右表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3° | -60.75 |
H2Se | 1.47 | 91.0° | -41.50 |
①H2Se的晶体类型为__________________;
②H2S的键角大于H2Se的原因可能__________________;
分子晶体
;;
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为___;(用元素符号表示)
(3)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为____________1:3
;若该晶体的晶胞参数为a pm,则该合金密度
为_______________g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
(4)Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁。
①1molFe(CO)5分子中含有σ键的数目为____________1:3
;
②该磁性氮化铁晶胞结构如图所示,该化合物的化学式____________。1:3
。。。

查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A-)不变
C.当pH为5.0时,饮料中![]() =0.16
=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH-)-c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对能量转化的认知中,不正确的是( )
A.电解水生成H2和O2时,电能主要转化为化学能
B.风力发电时,风能主要转化为电能
C.煤燃烧时,化学能主要转化为热能
D.白炽灯工作时,电能全部转化为光能
查看答案和解析>>
科目: 来源: 题型:
【题目】(12分)铈是一种重要的稀土金属元素,以下是其重要化合物Ce(OH)4的一种制备方法:
![]()
注:高铈是指溶液中Ce为+4价。
(1)高铈硫酸盐溶液可用于吸收硝酸工厂废气中的NO(如下图),则该反应过程中氧化产物为 。

(2)已知硫酸铈钠中各离子的物质的量之比为1:1:2,则硫酸铈钠的化学式为 。
(3)“还原”过程温度不能过高的原因是 。
(4)写出加入氨水时发生反应的离子方程式 。
(5)“氧化”过程若用NaClO代替O2,写出该反应的化学方程式 。
(6)为测定Ce(OH)4样品的纯度,现设计如下步骤:取上述样品2.68g用适量稀硫酸溶解后,加蒸馏水稀释至100ml。准确量取出20.00ml溶液于锥形瓶中,滴加2~3滴邻菲罗啉(指示剂),用0.1000mol·L-1 FeSO4标准溶液滴定至终点,并记录消耗FeSO4标准溶液的体积。将上述步骤重复2~3次,记录消耗标准溶液的平均体积为25.00ml,则产品的纯度为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2![]() 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如下:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如下:
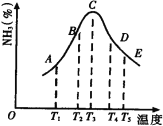
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是_______。
(2)此可逆反应的正反应是______反应。(放热、吸热)
(3)AC段的曲线是增函数,CE段曲线是减函数,试从反应速率和平衡角度说明理由。 ____________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质分类正确的是( )
A.KNO3是钾盐、硝酸盐,也是正盐
B.漂白粉、明矾、铝热剂都是混合物
C.有机玻璃、氮化硅都是有机高分子材料
D.CO、CO2、SO2均为酸性氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
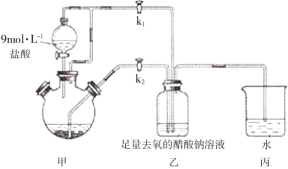
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量。
(1)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为_________。
(2) 实现步骤③中溶液自动转移至装置乙中的实验操作为_________。
(3) 装置丙中导管口水封的目的是__________________。
(4) 为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是_____ 。
A.先用盐酸洗,后用冷水洗 B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗 D.先用乙醇洗涤,后用乙醚洗
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.4g,则该实验所得产品的产率为_________(不考虑溶解的醋酸亚铬水合物,Mr[Cr(CH3COO)2]2·2H2O =376g/mol)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的空气,再加入碱液,调节pH至少为_________才能使铬的离子沉淀完全。
【已知Cr(OH)3的溶度积为6.3×10-31,![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
(7) 一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在。
查看答案和解析>>
科目: 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_________个未成对电子,Fe3+的电子排布式为 _。可用硫氰化钾检验Fe3+,现象是 。
(3)根据价层电子对互斥理论判断:SO42—的立体构型为_ ,H3O+ 的立体构型为 。
(4)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为___________,1mol乙醛分子中含有的![]() 键的数目为___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
键的数目为___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(5)Al单质为面心立方晶体,其晶胞如图。晶胞中铝原子的配位数为 。
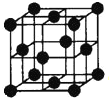
查看答案和解析>>
科目: 来源: 题型:
【题目】将22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.2molNO2和0.3molNO,下列说法正确的是
A.反应后生成的盐只有Fe(NO3)3
B.反应后生成的盐只有Fe(NO3)2
C.反应后生成的盐为Fe(NO3)2和Fe(NO3)3,其物质的量之比为1:3
D.反应后生成的盐为Fe(NO3)2和Fe(NO3)3,其物质的量之比为3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com