
科目: 来源: 题型:
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%。目前我国已经在技术上取得突破――用硫酸渣炼铁。Fe3+开始沉淀为氢氧化物的pH=1,沉淀完全时的pH为3.7。某学生探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:

请回答:
(1)写出固体E的化学式:__________________。试剂①是_______
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是_________
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)溶液H中溶质的化学式:__________________
(4)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为 。
方案二:

(5)此方案制得的氧化铝含有的主要杂质是:_______________
(6)写出由溶液M固体乙这个过程中,主要化学反应的离子方程式:
_____________________;___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
选项 | 二氧化碳 | 碳酸钠 | 转移的电子 |
A | 1mol | 2NA | |
B | 22.4L | 1mol | |
C | 106g | 1mol | |
D | 106g | 2NA |
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知20℃时的溶解度:Na2CO3:S=21.2g; NaHCO3:S=9.6g。则20oC恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3__________g(小数点后保留1位)
(2)向500mL KOH溶液中缓慢通入一定量的![]() 气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入
气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入![]() 气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
(3)将一定质量的钠加入到89g水中,完全反应后的溶液为100g,则该溶液的质量分数为________
(4)现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
① 取440mL甲与120mL乙反应,产生1.56g沉淀;
② 取440mL乙与120mL甲反应,也产生1.56g沉淀;
③ 取120mL甲溶液与400mL乙溶液反应,则产生3.12g沉淀;
通过必要的计算和推理判定:
甲溶液为 溶液,其物质的量浓度为 mol·L-1;
乙溶液为 溶液,其物质的量浓度是 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
探究浓度对醋酸电离程度的影响
用pH计测定25 ℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)写出醋酸的电离方程式:___________________________________________。
(2)醋酸溶液中存在的微粒有________________________________________。
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是________________________________________________________________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将(填“增大”、“减小”或“不变”)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。下列说法正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在这2 min内B和C两物质浓度都是逐渐减小的
查看答案和解析>>
科目: 来源: 题型:
【题目】A是一种重要的化工原料,它的产量可以衡量一个国家石油化工水平的高低。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。

(1)请写出A的结构简式 ;
(2)写出反应B+C→D的化学方程式 ;
(3)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是 mol;
(4)制备D的实验装置图如图所示:收集产物的试管中盛放的液体为 ;
装置中长颈漏斗除起冷凝作用外,另一重要作用是: 。

查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在在恒容的密闭容器中,能表示反应X (g) + 2Y (g)![]() 2Z (g)一定达到化学平衡状态的是:
2Z (g)一定达到化学平衡状态的是:
①X、Y、Z的物质的量之比为1:2:2
② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化
④ 单位时间内生成n molZ,同时生成2n molY
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】请仔细观察下列五种装置的构造示意图,完成下列问题。
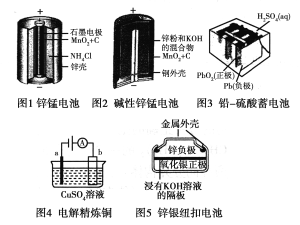
(1)锌锰电池存在自放电现象,主要原因是锌与NH4Cl反应,请结合离子方程式与文字说明原因:
。
(2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,则负极的电极反应式:________________。
(3)铅-硫酸蓄电池放电的总反应式:Pb+PbO2+2H2SO4=2PbSO4+2H2O,充电过程中,阳极附近c(SO42-)浓度将________(填“变大”、“变小”或“不变”),充电时阴极的电极反应式为:________________。
(4)电解精炼铜时,a极是________(填“纯铜”或“粗铜”)。锌银纽扣电池在工作过程中________(填物质名称)被还原。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
(1) 其达到平衡状态的标志是____________________。
①氨的生成速率与氨的分解速率相等
②断开1个N≡N键的同时有6个N—H键生成
③N2、H2、NH3的体积分数不再变化
④气体的总压强不变
⑤N2、H2、NH3分子数之比为1:3:2
⑥N2、H2和NH3的浓度相等
⑦v(N2)=1/3v(H2)
⑧v正(N2)=1/3v逆(H2)
⑨混合物的密度不变
⑩混合物的平均相对分子质量不变
A.①③④⑤⑦⑩ B.①③④⑧⑩
C.①③④⑤⑧⑩ D.全部
(2)从反应开始到达到平衡用N2表示该反应的速率为: mol·L-1·min-1。
(3)平衡时H2的物质的量浓度为 mol·L-1。
(4)H2的转化率是____________。
(5)平衡时混合气体中NH3的体积分数是_______%(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com