
科目: 来源: 题型:
【题目】NaCN为剧毒无机物。某兴趣小组查资料得知,实验室里的NaCN溶液可用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
实验Ⅰ.硫代硫酸钠晶体(Na2S2O3·5H2O)的制备:
已知Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水。现以Na2CO3和Na2S物质的量之比为2∶1的混合溶液及SO2气体为原料,采用如图装置制备Na2S2O3·5H2O。

(1)将Na2S和Na2CO3按反应要求的比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在蒸馏烧瓶中加入Na2SO3固体,在分液漏斗中注入____________(填以下选择项的字母),并按下图安装好装置,进行反应。
A.稀盐酸 B.浓盐酸 C.70%的硫酸 D.稀硝酸
(2)pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色浑浊。反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热。如果通入SO2过量,发生的化学反应方程式为________________;
实验Ⅱ.产品纯度的检测:
(3)已知:Na2S2O3·5H2O的摩尔质量为248 g/mol;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品a g,加水溶解后,滴入几滴淀粉溶液,用0.010 mol/L碘水滴定到终点时,消耗碘水溶液v mL。①滴定终点的现象是 ;②该样品纯度是______________________;
(4)滴定过程中可能造成实验结果偏低的是___________________;
A.锥形瓶未用Na2S2O3溶液润洗
B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数
C.滴定终点时仰视读数
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
实验Ⅲ.有毒废水的处理:
(5)兴趣小组的同学在采取系列防护措施及老师的指导下进行以下实验:
向装有2 mL 0.1 mol/L 的NaCN溶液的试管中滴加2 mL 0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10 mL 0.1 mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某种微生物燃料电池工作原理如图所示。下列有关该电池的说法中,正确的是
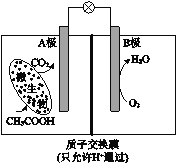
A.外电路电子从B极移向A极
B.溶液中H+由B极区移向A极区
C.电池工作一段时间后B极区溶液的pH减小
D.A极电极反应式为:CH3COOH - 8e-+2H2O=2CO2 +8H+
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分.表中所列字母分别代表一种元素.

试回答下列问题:
(1)请画出元素D的基态原子的价电子排布图______________;与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有______________种;
(2)A的最简单氢化物的中心原子的杂化形式为______________;C在空气中燃烧产物的分子构型为______________,与其互为等电子体的单质的分子式为______________;
(3)B单质晶体中原子的堆积方式如图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

①晶胞中B原子的配位数为______________,其堆积方式______________(填“是或否”)密置堆积。②若B原子的半径为d cm,用NA表示阿伏加德罗常数,M表示B原子的相对原子质量,则该晶体的密度为______________(用字母表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种T艺流程如下:
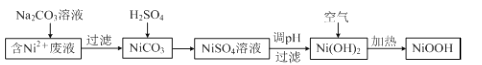
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
过滤时需用到的玻璃仪器有烧杯、 。
(2)写出碳酸镍与稀硫酸反应的离子方程式: 。
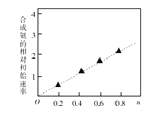
(3)硫酸镍溶液可用于制备合成氨的催化剂CoNi(1-n) Fe2O4。 如图表示在其他条件相同时合成氨的相对初始速率随催化剂中w值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是 。
(4)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:__ _。
(5)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOHyNi(OH)2。现称取9.18g样品溶于稀硫酸,加入100mL1.0mol/LFe2+标准溶液,搅拌至溶液澄清,定容至200mL。取出20.00mL,用0.010molL﹣1 的KMnO4标准溶液滴定,用去KMnO4标准溶液20.00mL,试通过计算确定x:y= 。[已知反应(未配平):NiOOH+Fe2++H+=Ni2++Fe3++H2O,Ni2+ +MnO4 -+H+![]() Ni3++ Mn2++H2O]
Ni3++ Mn2++H2O]
查看答案和解析>>
科目: 来源: 题型:
【题目】能源和环境保护是世界各国关注的热点话题。请回答下列问题:
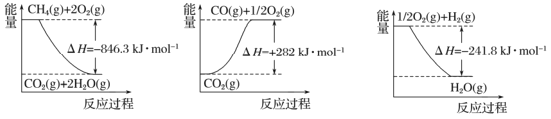
Ⅰ.目前“低碳经济”正成为科学家研究的主要课题。甲烷自热重整是一种先进的制氢方法,其反应方程式为CH4(g) +H2O (g) =CO (g) +3H2(g) 。
阅读下图,计算该反应的反应热△H=____________kJ·mol-1。
Ⅱ.收集和利用CO2是环境保护的热点课题。
500℃时,在容积为1L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g) +3H2 (g) ![]() CH3OH (g) +H2O (g) △H<0,测得CO2和CH3OH的浓度与时间的关系如图所示。
CH3OH (g) +H2O (g) △H<0,测得CO2和CH3OH的浓度与时间的关系如图所示。
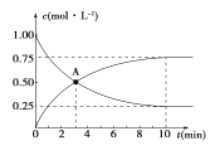
(1)0~10 min内v(H2)=_____________,
A点含义是_____________。
该反应平衡常数表达式K=____________。
(2)反应在500℃达到平衡后,改变反应温度为T,CH3OH的浓度以每分钟0.030 mol/L逐渐增大,经5 min又达到新平衡。T____________(填“>”、“<”或“=”)500℃,判断理由是___________________。
(3)温度为T时,反应达到平衡后,将反应容器的容积增大一倍。平衡向____________(填“正”或“逆”)反应方向移动,判断理由是____________。
Ⅲ.电化学法处理SO2是目前研究的热点。
利用双氧水吸收SO2可消除SO2污染,设计装置如图所示。
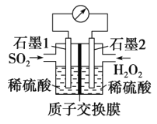
(1)石墨1为___________(填“正极”或“负极”);
正极的电极反应式为____________。
(2)若11.2 L(标准状况)SO2参与反应,则迁移H+的物质的量为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,不正确的是
A. 乙烯可以作水果的催熟剂
B. 石油分馏属于化学变化
C. 苯燃烧时火焰明亮,伴有浓烟
D. 冶炼金属是将金属从其化合物中还原出来
查看答案和解析>>
科目: 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类顺次排列.正确的是( )
A. H2SO4,Na2CO3,NaOH
B. HCl,NaOH,CuSO4
C. HNO3,酒精,NaCl
D. NaHSO4,Ca(OH)2,KCl
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:

已知:3NO3-+8Al+5OH-+2H2O![]() 3NH3↑+8AlO2-
3NH3↑+8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】 ⑴已知碳酸二级电离较偏铝酸的电离容易,而石炭酸的电离介于碳酸的一级电离与二级电离之间。下面的推论正确的是_________________:
①将CO2通入偏铝酸钠溶液中,溶液变浑浊,并生成碳酸钠或碳酸氢钠;②将CO2通入C6H5ONa溶液中,离子反应式为CO2+H2O+2C6H5O—![]() 2 C6H5OH+CO32—;
2 C6H5OH+CO32—;
③HCO3—在溶液中既能与AlO2—又能与Al3+反应,且都发生双水解;④往含有大量CO32—的溶液中加入C6H5OH得到澄清溶液,放出CO2气体;⑤向Al(OH)3的混浊液中加入Na2CO3溶液得不到澄清溶液;⑥相同温度,相同浓度的Na2CO3、C6H5ONa、NaHCO3、NaAlO2的稀溶液PH依次增大。
(2)浅绿色的Fe(NO3)2溶液中,存在如下平衡:Fe2++2H2O![]() Fe(OH) 2+2H+若在此溶液中加入盐酸后,用文字说明溶液颜色的变化及原因__________________.
Fe(OH) 2+2H+若在此溶液中加入盐酸后,用文字说明溶液颜色的变化及原因__________________.
⑶一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+。据此,回答下列问题:
①将反应3 Cu+8H+ +2NO3-=3Cu2++2NO↑+4H2O拆写为两个“半反应式”:
还原反应式: 。
②已知某反应的两个“半反应式”为:
CH4+10 OH--8e-=CO32-+7H2O, O2+2H2O+4e-= 4OH-,
则氧化还原反应方程式为 。
③此原理可用于电化学。锌—锰碱性电池广泛应用于日常生活。电池的总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。
该电池的正极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com