
科目: 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO![]() Cu+H2O所属的区域。
Cu+H2O所属的区域。
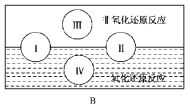
(2)“四种基本反应类型与氧化还原反应的关系”也可用B图表达。其中Ⅰ为化合反应,则Ⅱ为________反应。写出有水生成的符合反应类型Ⅲ的一个化学方程式:____________________。写出有水参加的符合反应类型Ⅳ的一个化学方程式_____________,其中水________(填“被氧化”或“被还原”或“既被氧化又被还原”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
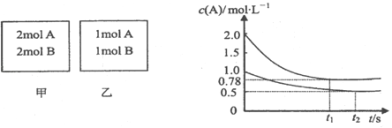
A.x可能等于2
B.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙)
C.将乙容器升温可使甲、乙容器内各物质的体积分数相同
D.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 molL﹣1<c(A)<1.56 molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等。已知:Ce4++Fe2+=Ce3+ +Fe3+。下列说法正确的是
A.可用电解熔融CeO2制取金属铈,铈在阳极生成
B.![]() 、
、![]() 是同素异形体
是同素异形体
C.铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2
D.铈的原子核外有58个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室常用A的饱和溶液制备微粒直径为1nm-l00nm的红褐色液相分散系.则该反应的化学方程式为:________________,将A 的溶液加热蒸干并灼烧,得到固体的化学式为:_____________。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,6mol/L的B溶液中逐滴滴入100ml 某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为________________。
(3)将A、B中两种金属元素的单质用导线连接,插入一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:________________________。
(4)C、D、E均是短周期中同一周期元素形成的单质或化合物,常温下D为固体单质,C和E均为气态化合物,且可发生反应:C+D![]() E.则:
E.则:
①写出C 的电子式:________________。
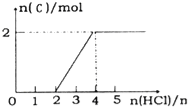
②将一定量的气体C通入某浓度的KOH溶液得溶液F,向F溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(C)的关系如图所示,则生成F 的离子方程式________________,F 中离子浓度由大到小的顺序为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一份含有FeCl3和FeCl2固体的混合物,为测定FeCl2的含量,进行如下实验:
①称取混合物样品的质量7.06g,将样品溶解
②向溶解后的溶液中,加入足量的双氧水
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4.00g
根据实验回答下列问题:
(1)样品溶解过程中需加入 ,以防止 ;
(2)写出溶解后的溶液与双氧水反应的离子方程式 ;
(3)过滤操作中除用漏斗外,还需要的玻璃仪器有 ;
(4)简述检验实验步骤④中沉淀已经洗涤干净的方法 ;
(5)通过实验所得数据,计算固体样品中FeCl2的质量分数: ;
(6)实验室采用如图装置制取少量无水FeCl3固体.(已知FeCl3固体易潮解,部分夹持仪器已略去.)
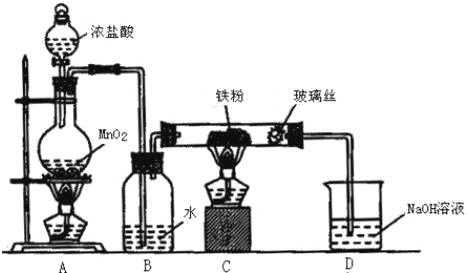
该装置存在明显缺陷,得不到无水FeCl3固体,请你对该装置进行合理的改进: .
查看答案和解析>>
科目: 来源: 题型:
【题目】离子键的强弱主要决定于离子半径和离子电荷数,一般规律是:离子半径小,离子所带电荷值大, 则离子键越强。①K2O ②MgO ③CaO三种物质离子键由强到弱的顺序是 ( )
A.K2O、MgO、CaO
B. MgO、CaO 、K2O
C. MgO、K2O、CaO
D. CaO、K2O 、MgO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com