
科目: 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO | SO | NO | NO | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________增加压强,NO的转化率__________(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率__________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反 应中,在反应ClO![]() +2SO
+2SO![]() ==2SO
==2SO![]() +Cl的平衡常数K表达式为__________。
+Cl的平衡常数K表达式为__________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。已知下列反应:
SO2(g)+2OH(aq)==SO![]() (aq)+H2O(l)ΔH1
(aq)+H2O(l)ΔH1
ClO(aq)+SO![]() (aq)==SO
(aq)==SO![]() (aq)+Cl(aq)ΔH2
(aq)+Cl(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO![]() (aq)ΔH3
(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ClO(aq)+2OH(aq)==CaSO4(s)+H2O(l)+Cl(aq)的ΔH=____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2010年10月1日,我国成功发射“嫦娥二号”卫星,嫦娥二号卫星由长征三号火箭承载发射。火箭燃料为偏二甲肼(C2H8N2),它是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是( )
A.偏二甲肼(C2H8N2)的摩尔质量为60
B.6.02×1023个偏二甲肼(C2H8N2)分子的质量约为60g
C.1 mol 偏二甲肼(C2H8N2)的质量为60 g·mol-1
D.60g偏二甲肼(C2H8N2)中含有NA个氮原子
查看答案和解析>>
科目: 来源: 题型:
【题目】设N0为阿伏加德罗常数的值。下列叙述正确的是( )。
A. 1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2N0
B. 12 g石墨烯(单层石墨)中含有六元环的个数为0.5N0
C. 25 ℃时pH=13的NaOH溶液中含有OH-的数目为0.1N0
D. 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9N0
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)“平炉”中发生的化学方程式为 。
(2)“平炉”中需要加压,其目的是 。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③CO2的等电子体COS,分子 COS电子式为_______________。
(4)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液滴定,滴定终点现象 ,该反应中,氧化剂与还原剂的物质的量之比为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学—有机化学基础】从薄荷油中得到一种烃A(C10H16),与A相关反应如下:
(1)H的分子式为 。
(2)B所含官能团的名称为 。
(3)含两个—COOCH3基团的C的同分异构体共有 种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为 。
(4)D→E的反应类型为 。
(5)G为含六元环的化合物,写出其结构简式: 。
(6)写出E→F的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
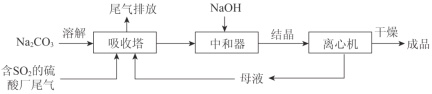
(1)举例说明向大气中排放SO2导致的环境问题:_________。
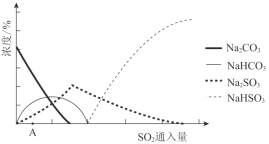
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________。
(3)中和器中发生的主要反应的化学方程式是_________。
资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________。
②结晶时应选择的最佳操作是_________(选填字母)。
A.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、_________。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是:![]() IO3-+
IO3-+![]() SO32- =
SO32- =![]() _______ +
_______ +![]() _______(将方程式补充完整)。
_______(将方程式补充完整)。
②成品中Na2SO3(M = 126 g/mol)的质量分数是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法错误的是
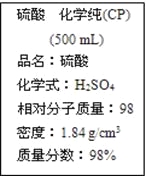
A. 该硫酸的物质的量浓度为18.4 mol/L
B. 该硫酸常用做干燥剂
C. 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为

A.2:7 B.5:4 C.1:1 D.7:2
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________(选填“酸性”、“碱性”或“中性”);原因是______________________。
(2)写出第二次氧化时发生反应的离子方程式_________________________。
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO__ _g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com