
科目: 来源: 题型:






查看答案和解析>>
科目: 来源: 题型:
 (2013?临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.
(2013?临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.| 320 |
| a3NA |
| 320 |
| a3NA |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| ①先后加入沉淀剂A、B |
| ②过滤 |
| ③先后通入NH3CO2 |
| ④过滤 |
| ⑤煅烧 |

| 84n-53m |
| 31m |
| 84n-53m |
| 31m |
查看答案和解析>>
科目: 来源: 题型:
 (2013?临沂二模)研究硫及其化合物的性质有重要意义.
(2013?临沂二模)研究硫及其化合物的性质有重要意义.| 气体 | SO2 | O2 | SO3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
| 1 |
| 6 |
| 1 |
| 6 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
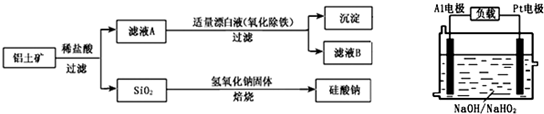
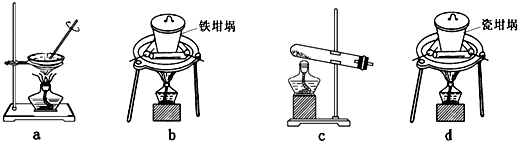
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com