
科目: 来源: 题型:
【题目】

(1)需要量取浓盐酸_________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外, 还必须用到的仪器有 、 。
(3)若实验遇到下列情况,所配溶液的浓度会(填“偏高”、“偏低”、“不变”)
A、定容时仰视刻度线_________;
B、容量瓶内壁附有水珠而未干燥处理______ ;
C、溶解后没有冷却便进行定容_____ 。
(4)将所配制的稀盐酸倒入5.92g Na2CO3和NaHCO3的固体混合物中,恰好完全反应,则原混合物中Na2CO3的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种以黄磷(P4)为原料制备次磷酸钠晶体的工艺流程如图所示:

(1)反应釜中被氧化的元素是________,PH3可以除去溶液中的Cu2+,反应为:24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4,反应转移12mol电子时,被氧化的PH3的物质的量是____________。
(2)搅拌釜中通入CO2的目的是__________________.
(3)滤渣2的主要成分为____________.
(4)次磷酸钠可用于化学镀.如在塑料镀件上化学镀铜,用含有Cu 2+和H2PO2-的溶液在pH=11条件下反应,次磷酸根离子被氧化为HPO32-,该反应的离子方程式为__________________.化学镀与电镀相比,优点是__________________、__________________(答两点)
(5)H3PO2是一元强酸,H3PO2与足量的NaOH溶液反应的离子方程式是_______________,NaH2PO2溶于水显碱性的原因是_______________(用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】若阿伏加德罗常数为NA,下列说法不正确的是
A.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
B.56g铁和足量氯气完全反应,氯原子得到的电子数为3NA
C.25℃、1.01×105Pa,64g SO2中含有的原子数为3NA
D.1mol FeCl3完全转化为Fe(OH)3胶体后形成的胶粒数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里用下列仪器和药品制取纯净的无水氯化铜。根据要求完成以下问题:

(1)按气体从左向右流动,装置②在④左边,则②中加入的液体是 ;
(2)装置⑤中发生反应的化学方程式是 ;
(3)实验开始时,应先点燃 (填装置序号)处的酒精灯,否则CuCl2中含有 (填化学式)杂质。待充分反应后,装置①的玻璃管中剩余物呈 色;
(4)某实验小组组装装置时,在①和⑥之间添加了一个盛有浓硫酸的洗气瓶,其作用是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产重铬酸钾。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图所示。反应器中涉及的主要反应是:6 FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐。写出氧化铝与碳酸钠反应的化学方程式:______________________。
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:_________________。
(3)步骤③中测定pH值的操作为:________________。
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
操作步骤 | 实验现象 | 结论 |
①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置。 | 试管中仍有固体物质 | 固体为_____________ |
②操作①后,过滤;在滤液中加入过量的____________。 | 有红褐色沉淀产生 | 沉淀为Fe (OH)3 |
③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2。 | _____________ | 生成物为Al (OH)3; |
(5)称取重铬酸钾(其式量为294)试样2.5000 9配成250 mL溶液,用移液管取出25. 00 mL于碘量瓶中,加入10 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需________和________________。
②若实验中共用去Na2S2O3标准溶液40. 00 mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)____________。(保留2位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】人们获得食盐的方式有多种,最主要的是海水晒盐。通过海水晾晒得到的粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验流程(试剂以化学式表示)
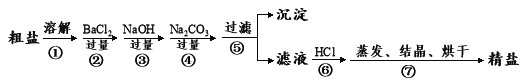
(1)BaCl2、NaOH、Na2CO3的加入顺序,必须保证___________在____________后
(2)溶解、过滤、蒸发过程中都使用到的玻璃仪器是_______ _________,蒸发时玻璃棒的作用是______________________
(3)经过⑤步骤之后得到的沉淀的成分为:________________________
(4)制得的精盐中不小心混入了硝酸钾晶体,用电子天平称取8.00g样品溶于水,向溶液中加入足量硝酸银溶液,将产生的沉淀过滤、洗涤、干燥,并称得其质量为14.35g,则该样品中氯化钠的质量分数为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于人体肝细胞组成元素及化合物的叙述,正确的是
A. 细胞中含量最多的元素是碳
B. 含有葡萄糖、麦芽糖等糖类物质
C. 组成肝细胞内酶的氨基酸均只含1个氨基
D. RNA分子种类和数量多于DNA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com