
【题目】糖类不含有,脂类不一定有,蛋白质不含有,而核酸一定有的元素是
A. N B. P C. S D. Fe
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】很多鲜花和水果的香味都来自酯的混合物。下图是乙烯等为原料制取乙酸乙酯的过程(部分产物和反应条件已略去)。

请回答下列问题:
(1)B的结构简式为 。
(2)乙烯与水反应生成A的反应类型为 。
(3)A与C反应生成乙酸乙酯的化学方程式为 ,其反应类型为 。
(4)实验室可用右图装置制取乙酸乙酯。
①在试管a中加好相关试剂后,还需要加入2—3块的碎瓷片,其作用是 。
②试管b中盛有饱和碳酸钠溶液,生成的乙酸乙酯在该溶液的 (填“上”或“下”)层,用分液的方法分离出该产品所需的主要仪器是 。试管b中的导管口应在液面上方而不伸入到液面以下,其原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。

(1)甲同学用上图所示装置测定CO2的质量。实验时稀硫酸是与样品中的_________(填“Na2CO3”或
"NaCl”)发生反应。仪器b的名称是_____________。洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是____________。
(2)乙同学用下图所示方法和步骤实验:

①操作I涉及的实验名称有__________、洗涤;操作Ⅱ涉及的实验名称有干燥、___________。
②乙测得的样品中Na2CO3质量分数的计算式为___________________。
(3)标准状况下,将672 mL CO2气通入50 mL1mol/LKOH溶液中,完全反应后,所得溶液中K2CO3和KHCO3的物质的量之比为(设反应前后溶液体积变化忽略不计)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法中正确的是
①常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA
②常温常压下,18gH2O中含有的电子总数为10NA
③将100 mL 0.1 mol·L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
④在反应KIO3+6HI==KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA
⑤常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA
⑥在标准状况下,0.5molNO与0.5molO2混合后气体分子数为0.75 NA
⑦1.0L 1.0 mol·L-1 Na2SiO3水溶液中含有的氧原子数为3NA
A.①⑤⑦ B.③④⑥
C.②④⑤ D.②③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿,软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分,闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14. 5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0. l000mol.L-1的标准Na2S2O3溶液滴定,消耗标准液50. 00mL,则软锰矿中MnO2含量_________。(己知:2KI+2 H2SO4+ MnO2=I2+2H2O+MnSO4+K2SO4;I2+2 S2O32-=2I-+ S4O62-)
II.研宄人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图l所示.

请回答下列问题:
(2)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2 (SO4)3等,试完成反应I中生成CuSO4和MnSO4的化学方程MnO2+CuS+___________=________+_________+CuSO4+MnSO4.
(3)反应II加入适量锌的作用是___________;如果锌过量,还会进一步发生反应的离子方程式为_____________。
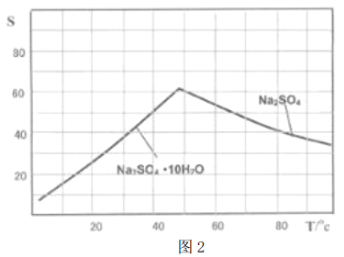
(4)图2是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/l00g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___________→用乙醇洗涤→干燥,用乙醇洗涤而不用水洗的原因是__________________________。
(5)用惰性电极电解MnSO4和ZnSO4制得Zn和MnO2的总反应是_______________________。
(6)本工艺可以循环利用的物质除MnO2、MnCO3、ZnCO3以外,还有___________(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以黄磷(P4)为原料制备次磷酸钠晶体的工艺流程如图所示:

(1)反应釜中被氧化的元素是________,PH3可以除去溶液中的Cu2+,反应为:24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4,反应转移12mol电子时,被氧化的PH3的物质的量是____________。
(2)搅拌釜中通入CO2的目的是__________________.
(3)滤渣2的主要成分为____________.
(4)次磷酸钠可用于化学镀.如在塑料镀件上化学镀铜,用含有Cu 2+和H2PO2-的溶液在pH=11条件下反应,次磷酸根离子被氧化为HPO32-,该反应的离子方程式为__________________.化学镀与电镀相比,优点是__________________、__________________(答两点)
(5)H3PO2是一元强酸,H3PO2与足量的NaOH溶液反应的离子方程式是_______________,NaH2PO2溶于水显碱性的原因是_______________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液能溶解Al(OH)3,则此溶液中可能大量共存的离子组是( )
A.Fe3+、NH4+、SCN-、Cl- B. K+、Na+、SO42-、HCO3-
C.Na+、Ba2+、Cl-、NO3- D. A13+、Na+、A1O2-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中含有杂质CaCl2,一学生设计了如下实验方法分离NaCl和CaCl2:

填空和回答下列问题:
(1)写出生成B物质的化学方程式 。
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是 。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是 (填字母或化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(g)![]() 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
①C的生成速率与C的分解速率相等②单位时间生成amolA,同时消耗1.5molB;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2: 3: 2.
A. ⑤⑥⑧ B. ②⑤⑧ C. ①③④ D. ②④⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com