
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿,软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分,闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14. 5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0. l000mol.L-1的标准Na2S2O3溶液滴定,消耗标准液50. 00mL,则软锰矿中MnO2含量_________。(己知:2KI+2 H2SO4+ MnO2=I2+2H2O+MnSO4+K2SO4;I2+2 S2O32-=2I-+ S4O62-)
II.研宄人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图l所示.

请回答下列问题:
(2)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2 (SO4)3等,试完成反应I中生成CuSO4和MnSO4的化学方程MnO2+CuS+___________=________+_________+CuSO4+MnSO4.
(3)反应II加入适量锌的作用是___________;如果锌过量,还会进一步发生反应的离子方程式为_____________。
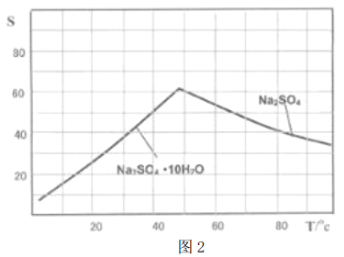
(4)图2是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/l00g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___________→用乙醇洗涤→干燥,用乙醇洗涤而不用水洗的原因是__________________________。
(5)用惰性电极电解MnSO4和ZnSO4制得Zn和MnO2的总反应是_______________________。
(6)本工艺可以循环利用的物质除MnO2、MnCO3、ZnCO3以外,还有___________(写化学式).
【答案】(1)60%;(2)2H2SO4;S;2H2O;
(3)将溶液中的硫酸铜转化为铜;Zn+Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+;
(4)趁热过滤,防止Na2SO4固体因溶解而减少,防止Na2SO4固体转变为Na2SO4·10H2O晶体;
(5)MnSO4+ZnSO4+2H2O![]() Zn+MnO2+2H2SO4;(6)Zn
Zn+MnO2+2H2SO4;(6)Zn
【解析】
试题分析:(1)已知2KI+2 H2SO4+ MnO2=I2+2H2O+MnSO4+K2SO4、I2+2 S2O32-=2I-+ S4O62-,则
MnO2~I2~2S2O32﹣
1 2
n 0.1000molL﹣1×0.050L
解得n=0.0025mol
1L溶液中含MnO2物质的量=0.0025mol×1000/25=0.1mol
则软锰矿中MnO2含量=![]() ;
;
(2)依据流程图分析判断,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,软锰矿和闪锌矿中的MnO2,CuS在酸性溶液中发生的氧化还原反应生成生成CuSO4、MnSO4和硫单质,根据原子守恒和电子得失守恒可知反应的化学方程式为:MnO2+CuS+2H2SO4=S↓+CuSO4+MnSO4+2H2O;
(3)流程分析,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,加入锌反应生成铜,锌的主要作用是和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会继续反应置换出铁,反应的离子方程式为:Zn+Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+;
(4)图像分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物;
(5)根据流程图中得到产物为二氧化锰和锌可知得到锌是锌离子在阴极得到电子析出,电极反应为:Zn2++2e﹣=Zn;二氧化锰是在阳极锰离子失电子生成,电极反应为:Mn2+﹣2e﹣+2H2O=MnO2+4H+,所以反应的化学方程式为MnSO4+ZnSO4+2H2O![]() Zn+MnO2+2H2SO4;
Zn+MnO2+2H2SO4;
(6)依据流程图可知能循环使用的物质为Zn、ZnCO3、MnCO3和MnO2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一支25mL滴定管,内盛溶液液面在15.00mL刻度处,当将滴定管内液体全部排出时,所得液体的体积是
A. 10.00mL B. 15.00mL C. 小于10.00mL D. 大于10.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一组结构或物质的元素组成很可能是不相同的
A. 细菌体内的DNA与细胞膜
B. 蓝藻细胞内的拟核与玉米的细胞壁
C. 骨骼肌细胞内的线粒体与染色体
D. 植物细胞的细胞壁与动物细胞中的糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】老北京传统小吃历史悠久,是北京独树一帜的文化符号,门钉肉饼是其中之一。制作门钉肉饼的部分原料如下:①牛肉②面粉③盐④花生油。请回答:
(1)富含油脂的是______(填序号,下同)。
(2)富含淀粉的是______。
(3)富含蛋白质的是______。
(4)属于调味剂的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯、铁的某些化合物在工业生产和生活中有着重要的作用。
(1)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。主要有两种制备方法:
方法一:
工业上常常用 KClO3和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 ,生成5molClO2转移电子 mol。
方法二:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
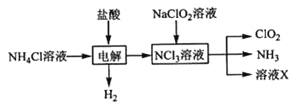
NCl3溶液和NaClO2溶液发生反应的离子方程式 。
X中大量存在的阴离子有_____ 。
(2)铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
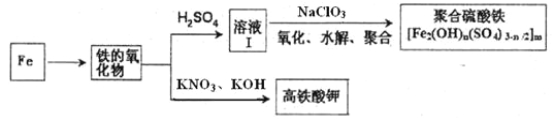
①检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)。
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.酸性高锰酸钾溶液
②在溶液Ⅰ中加入NaClO3写出其氧化Fe2+的离子方程式: 。
③Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平化学方程式:
□Fe2O3+□KNO3+□KOH——□ +□KNO2+□ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号内为杂质)的方法正确的是 ①乙烷(乙烯)光照条件下通入Cl2,气液分离②乙酸乙酯(乙酸)用饱和碳酸钠溶液洗涤、分液③苯(乙酸)用氢氧化钠溶液洗涤、分液④乙醇(乙酸)加足量生石灰、蒸馏
A. ①②③ B. ②③④ C. ①③④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物含C、H、O、N、S等元素。该化合物在动物体内一定不能( )
A. 抵御病菌和病毒的侵害
B. 做遗传物质
C. 改变化学反应的速度
D. 构成细胞核生物体的结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com