
科目: 来源: 题型:
【题目】 已知图一表示的是可逆反应CO(g)+H2(g) ![]() C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g)△H<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是( )
N2O4(g)△H<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是( )
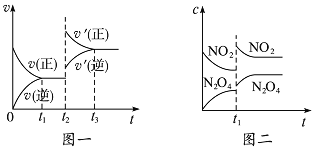
A.图一t2时改变的条件可能是升高了温度或增大了压强
B.图一t2时改变的条件是增大压强,则反应的△H增大
C.图二t1时改变的条件可能是升高了温度
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为元素周期表中部分短周期元素,其中Y原子最外层电子数是其电子层数的2倍。下列说法正确的是( )
R | ||
X | Y | Z |
A.Y的氢化物比Z的氢化物稳定
B.原子半径大小顺序是X>Y>R
C.Y、R形成的化合物YR3能使酸性KMnO4溶液褪色
D.四种元素中最高价氧化物对应的水化物酸性最强的是Y
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
①参加反应的物质本身的性质是影响化学反应速率的主要因素 ②光是影响某些化学反应速率的外界条件之一 ③决定化学反应速率的主要因素是浓度 ④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目: 来源: 题型:
【题目】食品卫生与身体健康密切相关,下列做法中对人体健康不会造成危害的是
A. 在沥青公路上翻晒粮食 B. 肉类食品用福尔马林保鲜
C. 竹笋用二氧化硫气体漂白 D. 用小苏打做发酵粉
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于元素的原子结构与元素性质的叙述正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.短周期元素形成离子后,最外层都达到8电子稳定结构
C.第三周期主族元素的最高正化合价等于它所处的主族序数
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】用质量分数为36.5%的盐酸(密度为1.16gcm﹣3)配制1molL﹣1的稀盐酸.现实验室仅需要这种盐酸220mL,试回答下列问题:
(1)配制稀盐酸时,除了用到量筒、烧杯、玻璃棒、胶头滴管,还需使用的玻璃仪器有 。
(2)计算已知盐酸的物质的量浓度为 。
(3)经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。
A.5mL | B.10mL | C.25mL | D.50mL |
(4)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号) 。
(5)在上述配制过程中,若定容时水加多后用滴管吸出多余的部分,则配制的稀盐酸浓度是 (填“偏高”、“偏低”或“无影响”);若定容时俯视刻度线,则配制的稀盐酸浓度是 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锰(MnSO4·H2O)是一种粉色晶体,易溶于水,不溶于乙醇,是重要的微量元素肥料之一,可促进多种经济作物生长从而增加其产量。甲、乙两组同学拟制取硫酸锰并探究其性质。
(1)甲组同学拟制备MnSO4·H2O。
首先称取5.0gMnO2于200mL烧杯中,加入12.00mL6.00mol/L硫酸和6.00mLH2O。然后再称取8.0g草酸晶体[H2C2O4·2H2O],将溶液稍加热后,在搅拌下缓慢向烧杯中分批加入草酸晶体粉末。待充分反应后过滤得到浅粉色溶液,将溶液蒸发浓缩,加入适量乙醇冷却结晶,干燥后得MnSO4·H2O。
①实验中配制100mL6.00mol/L硫酸时,需要的仪器有量筒、烧杯、玻璃棒、胶头滴管和____________。
②在上述过程中,若MnO2的转化率为97.44%,则最终得到MnSO4·H2O晶体的质量为____________g。
(2)乙组同学拟研究硫酸锰的高温分解产物,用下图装置测量生成的Mn3O4、SO2、SO3及水蒸气。

①装置正确的连接顺序为_________________(按气流方向,填装置序号)。
②实验自始至终均需通入N2,其目的是______________。
③若起始时,在装置Ⅱ中加入MnSO4·H2O50.7g,充分反应后,测得装置Ⅲ增重6.4g,则MnSO4·H2O分解的化学方程式为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是
A.2 mol水的摩尔质量和1 mol水的摩尔质量
B.200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】奥运会篮球比赛用球男女有别。男子篮球比赛用7#球,内部空间体积大约是7.35L,比赛时内部压强约为170kPa。己知,在25℃,100kPa时,气体摩尔体积约为24.5L/mol。假设比赛场馆温度为25℃,下列说法中正确的是
A.比赛时,篮球内一般充填氮气
B.比赛时,篮球内约有空气0.3mol
C.比赛时,篮球内约有空气14.8g
D.当25℃,170kPa时,Vm>24.5L/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com