
科目: 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() kJ·mol
kJ·mol![]() )
)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强(pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
请写出下列物理量的关系:
(1)浓度c1与c2__________________2c2与c3 ________________
(2)能量a与b __________________2b与c___________________
(3)压强p1与p2_________________2p2与p3 __________________
(4)转化率α1与α2_________________α2与α3___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)按要求写出下列反应的离子方程式
①人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用胃舒平【氢氧化铝】给病人治疗。该反应的离子方程式为___________________;
②实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式___________________;常用澄清石灰水检验CO2气体的离子方程式是___________________;
③表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是___________________;反应片刻后,可观察到有气体产生,其离子方程式是___________________;
(2)按要求将化学方程式改为离子方程式
2Na2O2 +2H2O =4NaOH +O2↑___________________;
(3)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式___________________;
(4)有一瓶无色澄清溶液,其中可能含有H+、Na+、Mg2+、Ba2+、Cl-、SO42-、CO32-离子。现进行以下实验:
A、用PH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有 ;肯定不存在的离子有 ;
可能存在的离子有 。
②写出C中发生反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2,电解过程中,以下判断正确的是( )
Al2O3+3H2,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e═Pb2++2H2O | 阳极:2Al+3H2O6e═Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化锡是无色液体,熔点-33℃,沸点114℃。氯气与金属锡在加热时反应可以用来制备SnCl4 , SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。
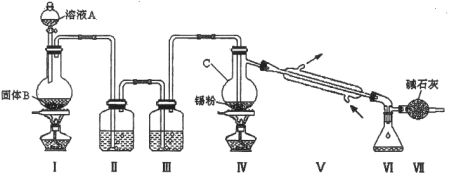
(1)仪器C的名称为: ;
(2)装置Ⅰ中发生反应的离子方程式为: ;
(3)装置Ⅱ中的最佳试剂为 ,装置Ⅶ的作用为 ;
(4)若装置连接顺序为Ⅰ—Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为 。
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为 ;
(6)若Ⅳ中用去锡粉11.9 g,反应后,Ⅵ中锥形瓶里收集到23.8 g SnCl4 ,则SnCl4 的产率为 。
查看答案和解析>>
科目: 来源: 题型:
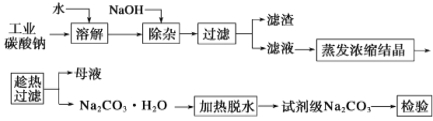
【题目】碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺流程如下:
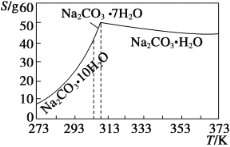
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为_____________________________。
(2)“趁热过滤”的原因是_________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是________(写出一种)。
(4)已知:Na2CO3·10H2O (s)===Na2CO3(s)+10H2O(g) ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关金属及其化合物的说法正确的是
A.铝和氢氧化钠溶液反应生成Al(OH)3和H2O
B.钠在空气中燃烧生成淡黄色的Na2O
C.铁在高温下与水蒸气反应生成Fe2O3和H2
D.用碳酸钠和氢氧化钙反应制NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是
A.甲苯分子中共平面的原子最多是12个
B.对二甲苯分子中有4个碳原子在一条直线上
C.1—丁烯分子中的4个碳原子一定不在同一平面内
D.2—丁烯分子中的4个碳原子一定不在同一平面内
查看答案和解析>>
科目: 来源: 题型:
【题目】生物大分子在生物体的生命活动中具有重要的作用。碳原子本身的化学性质,使它能够通过化学键连接成链或环,从而形成各种生物大分子。可以说,地球上的生命是在碳元素的基础上建立起来的。以上事实说明( )
A. C元素能组成所有的化合物
B. C元素是构成细胞的最基本的元素
C. C元素是各种大分子中含量最多的元素
D. C元素比其他元素重要
查看答案和解析>>
科目: 来源: 题型:
【题目】欲用98%的浓硫酸(ρ=1.84g·cm-1)配制为1mol·L-1的稀硫酸100ml。
(1)选用的主要仪器有:
①玻璃棒,②_________,③胶头滴管,④量筒,⑤__________。
(2)需要用量筒量取98%的浓硫酸________ml。
(3)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.洗净2~3次并转入容量瓶
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为_____________________。
(4)简要回答下列问题:
①如果实验室有10mL、20mL、50mL的量筒,则所需的浓硫酸应选用____________mL的量筒最好
②任何实验都有误差,下列哪些操作会使所配的溶液浓度偏大____________
A.配置前,量取浓硫酸时发现量筒不干净用水洗净后直接量取
B.将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,若搅拌过程中有液体溅出
C.在转入容量瓶前烧杯中液体未冷却至室温
D.洗涤烧杯和玻璃棒2~3次,洗涤液未转入容量瓶
E.定容时俯视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com