
科目: 来源: 题型:
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )

A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32-和NO3-,一定含有SO42-
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+):c(Al3+):c(Mg2+)=1:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,向一固定容积的密闭容器中加入 1mol A和 2mol B,发生下述反应:A(g)+2B(g) ![]() 3C(g)+2D(s)(放热反应)。达到平衡时生成了1.8 mol C。
3C(g)+2D(s)(放热反应)。达到平衡时生成了1.8 mol C。
(1)在相同条件下,若向该容器中改为加入0.3mol A、0.6 mol B,要使平衡混合气体中C物质的体积分数与原平衡的相同,在D足量时,则还应加入 mol的物质C。
(2)若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.8 mol 。则D的起始物质的量n(D)应满足的条件是:n(D)___________。
当改变温度或压强时,有可能改变物质的聚集状态,对平衡产生重大影响。
(3)若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是:_____________________;
(4)若将容器改为容积可变的容器,在一定温度和常压下,建立上述平衡之后,A的物质的量浓度为a mol/L。现持续增大压强,当:
①当压强为原来1.5倍时,A的平衡时物质的量浓度为m mol/L,测得m=1.5a;
②当压强为原来10倍时,A的平衡时物质的量浓度为n mol/L,测得n >10 a;
③当压强为原来100倍时,A的平衡时物质的量浓度为p mol/L,测得p<100a。
试解释形成这种结果的可能的原因:
①1.5倍时: ;
②10倍时: ;
③100倍时: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四种溶液中,一定存在SO42- 的是( )
A.向甲溶液中加入Ba(NO3) 2溶液,产生白色沉淀
B.向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸,沉淀不溶解
C.向丙溶液中加入盐酸酸化,再加入BaCl2溶液,有白色沉淀产生
D.向丁溶液中加入硝酸酸化,再加入Ba(NO3)2溶液,有白色沉淀产生
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3
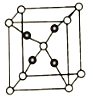
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
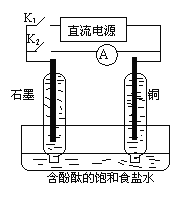
A. 断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目: 来源: 题型:
【题目】全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)![]() VO2+(黄色)+V2+(绿色)+2H+ 下列说法错误的( )
VO2+(黄色)+V2+(绿色)+2H+ 下列说法错误的( )
A. 充电时,反应每生成2molH+时电子转移的物质的量为2mol
B. 放电过程中,正极附近溶液的酸性减弱
C. 放电时,正极反应为VO2++2H++e-=VO2++H2O
D. 充电时,阳极附近溶液由蓝色逐渐变为黄色
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产和生活中应用十分广泛。已知:![]() (浓)=
(浓)= ![]() ,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。
,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。

(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是 。(选填A或B或c)
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的化学方程式: 。
(3)实验室收集氯气的方法是 。
(4)常用![]() 溶液吸收氯气防止污染。写出该反应的化学方程式 。
溶液吸收氯气防止污染。写出该反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】浊液、胶体、溶液三种分散系的本质区别为分散质粒子的大小。如下图A、B、C分别代表分散质粒子。

把10 mL淀粉胶体和5mLKCl溶液的混合液加入用半透膜制成的袋内,将此袋浸入盛有蒸馏水的烧杯中。2min后,用两支试管各取烧杯中的液体5mL,并做如下实验:
(1)向其中一支试管里滴加少量AgNO3溶液,其现象是_______________。
(2)向另一支试管里滴加少量的碘水,其现象是________________。
(3)由上述实验得出的结论是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入到含1 mol FeI2溶液中: 2Fe2++2I-+2Cl2==2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-==HClO+HSO | 正确;说明酸性: H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合:2AlO | 正确;AlO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com