
科目: 来源: 题型:
【题目】“纳米材料”是指直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是
A.能全部透过半透膜 B.有丁达尔效应
C.所得溶液一定能导电 D.所得物质一定为悬浊液或乳浊液
查看答案和解析>>
科目: 来源: 题型:
【题目】填写下列空白:
(1)标准状况下,1.1 g某气态氧化物RO2的体积为0.56 L。该气体的摩尔质量是 。
(2)标准状况下,密度为1.25 g·L-1的CO2与CH4组成的混合气体中,CO2的体积分数为 ,该混合气体对氢气的相对密度为 。
(3)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该化合物加热至结晶水全部失去,剩余的残渣为b g,则n= 。
(4)将标准状况下体积为a L的HCl气体溶于1000g水中,得到盐酸的密度为b g/cm3,则该盐酸的物质的量浓度为 mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g) ![]() Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________,该反应为__________反应(填吸热或放热)。若改变条件使平衡向正反应方向移动,则平衡常数_____________(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是___________。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3) 将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应CO (g) + H2O (g)![]() CO2 (g) + H2 (g),得到如下三组数据:
CO2 (g) + H2 (g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 900 | a | b | c | d | t |
①实验A中以υ(H2) 表示的反应速率为 。
②通过计算可知,CO的转化率实验A 实验B(填“大于”、“等于”或“小于”),该反应的正反应为 (填“吸”或“放”)热反应。
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是 (用含a、b的数学式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】298K下,将1mol蔗糖溶解在1L水中,此溶解过程中体系的G = H-TS和S的变化情况是
A. G>0,S<0 B. G<0,S>0 C. G>0,S>0 D. G<0,S<0
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关细胞中元素和化合物的叙述,正确的是 ( )
A. C是构成细胞的基本元素,在人体活细胞中含量最多
B. 脂肪分子中含H比糖类多,是主要的能源物质
C. 氨基酸脱水缩合产生水,水中的氧来自氨基酸的羧基
D. RNA和DNA主要组成元素的种类不同,碱基种类不完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】
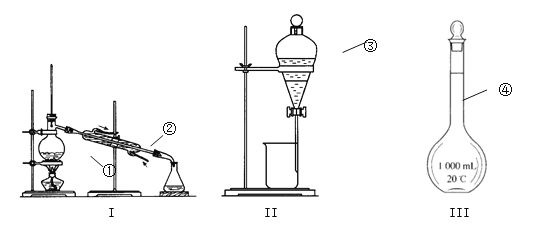
① ;② ;③ ;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填仪器序号)
(3)若用四氯化碳萃取碘水中的碘,振荡静置如图Ⅱ,可观察到液体分层,上层为 层(填“H2O”或“CCl4”);下层呈 色。分液后再用装置Ⅰ进行分离的方法称作 ,在加热前,①中要加入少量碎瓷片,目的是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体。回答下列问题:
(1)A分别与B、C形成的最简单化合物中,稳定性 > (用分子式表示),其中A与B形成的最简单化合物分子的空间构型为 ;
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为 。
(3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1∶1,则丙中含有的化学键类型是 ;
(4)B元素的最高价氧化物对应的水化物与其氢化物反应生成的盐的水溶液呈 性(填“酸”、“碱”或“中”),用离子方程式解释原因 ;
(5)写出实验室制取单质E的离子方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A. 有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B. 工业上通过电解氯化钠溶液制备金属钠和氯气
C. 室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D. 用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com