
科目: 来源: 题型:
【题目】NH3在工业生产中有着重要的用途。下列关于NH3的性质叙述不正确的是
A. 密度比空气小 B. 极易溶于水
C. 可由N2和H2作为原料进行工业生产 D. 任何条件下,不能与氧气反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在5L密闭容器中,通入5molN2和8molH2,在一定条件下生成NH3,反应进行到2min时,测得容器内有4molNH3.求:
(1)2min内的平均反应速率v(N2),v(H2),v(NH3).
(2)2min时N2,H2的浓度.
查看答案和解析>>
科目: 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】某容积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C。若维持温度和压强不变,当达到平衡时,容器容积为VL,其中C气体的体积占10 % ,下列推断正确的是( )
2C。若维持温度和压强不变,当达到平衡时,容器容积为VL,其中C气体的体积占10 % ,下列推断正确的是( )
①原混合气体的体积为1.2L
②原混合气体的体积为1.1L
③反应达到平衡时气体A消耗掉0.05VL
④反应达到平衡时气体B消耗掉0.05VL
A.②③ B.②④ C.①③ D.①④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是:( )
A.在100℃、101kpa条件下,液态水的气化热为40.69kJ/mol,则H2O(g) ![]() H2O(l)的△H=40.69kJ/mol
H2O(l)的△H=40.69kJ/mol
B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体的溶液中,都有c(Mg2+)=c(CO32-)=6.82×10-6
C.已知: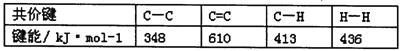 ,则可以计算出反应
,则可以计算出反应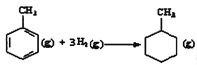 的△H为-384kJ/mol
的△H为-384kJ/mol
D.常温下,在0.10mol/L的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案
方案一 滴定法:用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式 。
(2)某同学设计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)
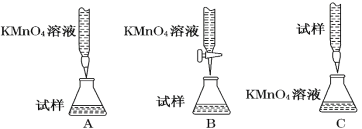
(3)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管、玻璃棒外,还需 (填仪器名称)。在溶液配制过程中,下列操作会导致配制结果偏低的是___________(填写代号)。
a.定容时,俯视容量瓶刻度线
b.容量瓶在使用前内有少量蒸馏水
c.转移溶液后的烧杯、玻璃棒未洗涤
d.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
A.浓盐酸 B.稀硫酸 C.稀硝酸 D.浓硫酸
方案二 称量法:操作流程如下:

(5)写出步骤②中H2O2氧化Fe2+ 的离子方程式 。步骤②中除用H2O2外还可以使用的物质是 ,步骤②是否可以省略 ,理由是 。
(6)步骤④一系列操作依次是:过滤、洗涤、 、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应FeO(s)+CO(g) ![]() Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com