
科目: 来源: 题型:
【题目】用离子方程式解释以下指定反应,书写正确的是( )
A. 亚硫酸钠溶液显碱性:SO32-+2H2O=H2SO3+2OH-
B. (NH4)2FeSO4溶液与过量NaOH溶液混合制取氢氧化亚铁:Fe2++2OH-=Fe(OH)2
C. NaAlO2溶液中通入过量CO2制取氢氧化铝:2AlO2-+CO2+3H2O=2Al(OH)3+CO32-
D. 铁红溶于HI酸溶液:Fe2O3+6H++2I-=2Fe2++I2+3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有OH﹣,CO32﹣,AlO2﹣,SiO32﹣,SO42﹣,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )

A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32﹣与AlO2﹣的物质的量比为3:4
D.原溶液中一定含有的离子是OH﹣,CO32﹣,SiO32﹣,AlO2﹣,K+
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO![]() +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式:_______________________。
(4)请配平以下化学方程式:
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH===
NaOH===![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从碘水中分离出I2,选择装置 (填代表装置图的字母);该分离方法的名称为 。
(2)A中装置①的名称是_________________,该装置通常不选择球形冷凝管和蛇形冷凝管的原因是:__________________
下列操作与上图A采用同一原理的是____________(填选项代号)



① ② ③
(3)利用装置C对过滤所得的固体洗涤的具体操作方法是:______________________
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:

问题1:粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;
③加入过量的NaOH溶液;④调节溶液的pH等于7;
⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是_____________(填写序号字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题2:若在实验室中模拟由海水到氯化钠晶体的过程,则用到的主要装置是 (从给定的四种装置中选择)。
查看答案和解析>>
科目: 来源: 题型:
【题目】分人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

在阳极区发生的反应包括 和H ++ HCO3-= H2O + CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下: H2(g) + 1/2 O2(g) ="==" H2O(g) ΔH1=" -242" kJ/mol
CH3OH(g) + 3/2 O2(g) ="==" CO2(g) + 2 H2O(g) ΔH2=" -676" kJ/mol
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
② 下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。

(3)在密闭的再生装置中,加入5 mol H2与2 mol CO2发生反应生成甲醇,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示,下列说法正确的是

A.P1> P2> P3>P4 |
B.甲醇的物质的量分数越高,反应的平衡常数越大 |
C.图示中,该反应的温度变化为:T1> T2> T3>T4 |
D.T4、P4、时,H2的平衡转化率为60% |
(4)已知某种甲醇燃料电池中,电解质溶液为酸性,示意图如下:

工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列图像的分析正确的是
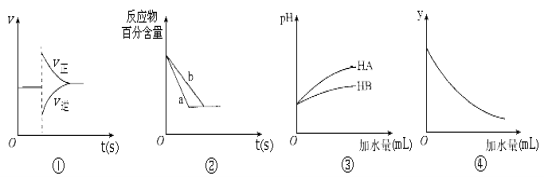
A.图①表示在N2(g)+3H2(g)![]() 2NH3(g)达到平衡后,减少NH3浓度时速率的变化
2NH3(g)达到平衡后,减少NH3浓度时速率的变化
B.图②中a、b曲线分别表示反应H2(g)十I2(g)![]() 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
C.图③说明HB是比HA更弱的酸
D.图④中的y可表示将冰醋酸加水稀释时溶液导电能力的变化情况
查看答案和解析>>
科目: 来源: 题型:
【题目】1L某混合溶液中可能含有的离子如下表:
可能大量含有的阳离子 | H+、NH4+、Al3+、K+ |
可能大量含有的阴离子 | Cl﹣、Br﹣、I、ClO、AlO2﹣、CO32- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.

①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有 ,
③要确定其存在可补充做的实验操作是 ;
④肯定不存在的阴离子有 .
(2)经检测,该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积 (标准状况) | 2.8L | 5.6L | 11.2L |
n(Cl﹣) | 1.25mol | 1.5mol | 2mol |
n(Br﹣) | 1.5mol | 1.4mol | 0.9mol |
n(I﹣) | a mol | 0 | 0 |
原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行如下反应:2X(g) + Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.达到平衡时X浓度为0.04 mol/L
B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L
C.若增大压强,平衡向正方向移动,平衡常数变大
D.若升高温度,X的体积分数增大,则该反应的H>0
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得
ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
A.H2C2O4在反应中被还原 B.1 molKClO3参加反应有2mol电子转移
C.ClO2是氧化产物 D.KClO3在反应中得到电子
查看答案和解析>>
科目: 来源: 题型:
【题目】在一固定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g);△H= Q KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);△H= Q KJ/mol其化学平衡常数K和温度t的关系如下:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)上述反应中Q 0(选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变 b.反应热△H不变
c.v正(H2) =v逆(CO) d.CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:850℃时物质的浓度(mol/L)的变化
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:850℃时物质的浓度(mol/L)的变化
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c 2 | c 3 | c 3 |
4 | c 1 | c 2 | c 3 | c 3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①计算:3 min时CO的浓度 c 1 = mol/L,H2O (g)的转化率= 。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是 表中5min~6min之间数值发生变化, 可能的原因是
a .增加水蒸气 b.增加氢气浓度 c.使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com