
科目: 来源: 题型:
【题目】(探究题)如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。

请回答:
(1)B极是电源的,一段时间后,甲中溶液颜色,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明_________________在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__________。
(3)现用丙装置给铜件镀银,则H应是__________,电镀液是__________溶液。
(4)若将C电极换为铁,其他装置都不变,则甲中发生的总反应的离子方程式为:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为 。
②下列叙述不正确的是 。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个![]() 键和1个大
键和1个大![]() 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
(2) Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子[Fe(CN)6]4 -中不存在 。
A、共价键
B、非极性键
C、配位键
D、σ键
E、π键
写出一种与 CN- 互为等电子体的单质分子式 。
(3)根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于 区。
(4)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
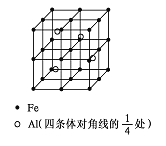
① 确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)19g某金属氯化物ACl2中含有0.4molCl-离子,则ACl2的摩尔质量是____________, A的相对原子质量是___________。
(2)同温同压下,质量相同的五种气体:①CO2②H2③O2④CH4⑤SO2,所占体积由大到小的顺序是(填序号,下同) ; 密度由大到小的顺序是 。
(3)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体的平均摩尔质量为 。
(4)VmLAl2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中SO42-的物质的量浓度是 mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子在溶液中能大量共存的是
A. Ca2+、HCO3-、Cl-、K+ B. Al3+、NH4+、CO32-、Cl-
C. Ba2+、Na+、NO3-、SO42- D. H+、NH4+、I-、S2O32-
查看答案和解析>>
科目: 来源: 题型:
【题目】据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是
A.Fe -2e-=Fe2+ B.2H2O+O2+4e-=4OH-
C.2H++2e-=H2↑ D.4OH-- 4e-=2H2O+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生 的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H2=-175.6kJmol-l(反应II)
CaS(s)+4CO2(g) △H2=-175.6kJmol-l(反应II)
请冋答下列问题:
(1)反应I能够自发进行的条件是____________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应II的Kp="___________" (用表达式表示)。
(3)假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是______________。

(4)通过监测反应体系中气体浓度的变化判断反应I和II是否同时发生,理由是___________。
(5)图I为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有__________。
A.向该反应体系中投入石灰石 B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数 D.提高反应体系的温度
(6)恒温恒容条件下,假设反应I和II同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)
随时间t变化的总趋势图。

查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g) ![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Z为0.3 mol/L B.Y2为0.4 mol/L
C.X2为0.2 mol/L D.Z为0.4 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是高温下某反应的微观过程.下列说法中正确的是

A.该反应属于分解反应
B.图中的两种化合物都属于氧化物
C.该反应中元素的化合价没有变化
D.反应前后原子的种类改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com