
科目: 来源: 题型:
【题目】有关水在人体中的作用,下列说法正确的是( )
A. 水是一种很好的溶剂
B. 水在人体内没有调节体温的作用
C. 饮用水越纯净越好
D. 没有污染的水就是纯净水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写错误的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-===2AlO2-+H2↑
B.Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-===AlO2-+2H2O
C.NaAlO2溶液中通入少量的CO2:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-
D.Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-===2AlO2-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】关于食物的酸碱性,下列说法正确的是( )
A. 食物溶于水后的溶液中pH小于7,则为成酸性食物
B. 由碳、氮、硫、磷等元素组成的蛋白质是酸性食物
C. 蔬菜、水果多含钾、钠、钙、镁等盐类,习惯称为酸性食物
D. 柠檬酸是酸性食物
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是 (填“吸热”或“放热”)反应。

(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)500℃ K3= ;反应③△H 0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆)(填“>”“=”或“<”)

(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲspan>时,改变的条件是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中c(NO3-)比100mL2 mol/L硝酸钡溶液中c(NO3-) 大的是( )
A .300mL 1mol/L的硝酸钠溶液
B .200mL 1.5mol/L的硝酸镁溶液
C .100mL 1.5mol/L的硝酸铝溶液
D .200mL 3mol/L的硝酸钾溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为10.00 g的该结晶水合物,分别制成溶液。
一份加入足量NaOH溶液,生成蓝色沉淀,将此悬浊液加热,逸出的气体能使湿润的红色石蕊试纸变蓝,此气体恰好可被50.00mL1.00 mol/L盐酸完全吸收。同时蓝色沉淀变为黑色沉淀;
另一份加入足量的BaCl2溶液,生成不溶于稀硝酸白色沉淀,经过滤、洗涤、干燥称其质量为11.65g。
(1) 该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式(写出计算过程,注意解题规范)。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法I | 用碳粉在高温条件下还原CuO |
方法II | 用肼(N2H4)还原新制Cu(OH)2 |
方法III | 电解法,反应为2Cu+H2O |
(1)已知:2Cu(s)+![]() O2(g)=Cu2O(s)△H=﹣akJmol﹣1
O2(g)=Cu2O(s)△H=﹣akJmol﹣1
C(s)+![]() O2(g)=CO(g)△H=﹣bkJmol﹣1
O2(g)=CO(g)△H=﹣bkJmol﹣1
Cu(s)+![]() O2(g)=CuO(s)△H=﹣ckJmol﹣1
O2(g)=CuO(s)△H=﹣ckJmol﹣1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H= kJmol﹣1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: .
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为 .
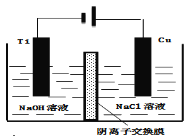
(4)方法III采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)![]() 2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10﹣5molL﹣1min﹣1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组研究可逆反应AsO43—+2I—+2H+![]() AsO33—+I2+H2O时,设计了如图所示的原电池:
AsO33—+I2+H2O时,设计了如图所示的原电池:

(1)电池工作时,盐桥中的阴离子向 极移动(填C1或C2);若向B池里滴加NaOH溶液,平衡向 方向移动,此时C2极的电极反应式为 。
(2)下列判断正确的是 。
a.微安表指针为0时,该反应处于平衡状态。
b.向A池中加入淀粉溶液,溶液变蓝说明该反应处于平衡状态。
c.AsO43—、AsO33—离子浓度相等时,该反应处于平衡状态。
(3)若在5min时间内电路中通过了1.204×104库伦电量,用I—浓度的变化来表示的化学反应速率为 。
(4)该反应的平衡常数表达式K= 。若升高温度,K值增大,则正反应的△H 0。(填“>”、“<”或“=”)
(5)已知反应达到平衡时,AsO43—离子转化率为25%,则I—离子的转化率 。
a.大于25% b.小于25%
c.等于25% d无法确定
(6)反应达到平衡后,若将AsO43—、I—、H+、AsO33—、I2的浓度均减少到原来的一半,上述平衡向 方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com