
科目: 来源: 题型:
【题目】现有下列十种物质:①液态HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-===H2O,该反应的化学方程式为_____________________。
(2)⑩在水中的电离方程式为___________________________。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能
治疗胃酸过多,请写出其反应的离子方程式:________________________;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式:________________________。
(4)写出下列反应的离子方程式
向Ba(OH)2溶液中逐滴加入稀硫酸________________________。
向Ba(OH)2溶液中通入过量的CO2_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学是一门以实验为基础的自然科学。请回答下列问题:
(1)下列说法中,符合实验规范要求的是 (填字母)。
A.闻气体的气味时,应用手在瓶口轻轻煽动,使少量的气体飘进鼻孔
B.在实验室做铜和浓硝酸反应制备二氧化氮的实验时,应该在通风橱中进行
C.实验中当有少量的钠剩余时,用纸包裹好后将其放入垃圾桶中
D.用容量瓶稀释某一浓度的硫酸溶液
(2)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
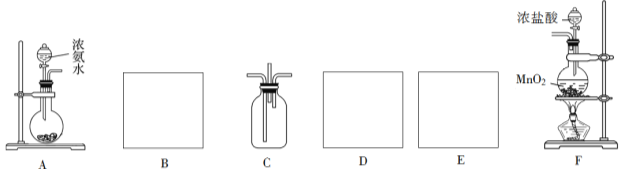
请回答下列问题:
①装置F中发生反应的离子方程式为____________________。
②装置A中的烧瓶内固体可选用_________(填字母)。
A.碱石灰 B.生石灰
C.二氧化硅 D.五氧化二磷
③线框内应添加必要的除杂装置,请从下图的备选装置中选择,并将编号填入下列空格:
B_________,D__________,E_________。
Ⅰ | Ⅱ | Ⅲ | |
备选装置 |
|
|
|
查看答案和解析>>
科目: 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:
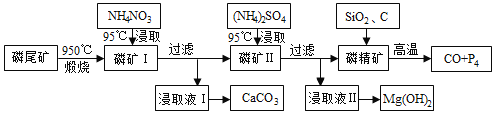
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是__________。
(4)在浸取液II中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】今有①CH3COOH ②HCl ③H2SO4三种溶液。根据要求回答下列问题:
(1)当它们pH相同时,其物质的量浓度最大的是 (填序号)
(2)当它们的物质的量浓度相同时,其pH最小是 (填序号)
(3)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为 (填序号)。
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为 ;此时所得到的三种溶液的pH大小关系为 .
(5)若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
(6)FeCl3可做净水剂,净水原理是 (用离子方程式表达),FeCl3溶液中的离子浓度从大到小顺序是
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁。
某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如下探究实验,请回答下列问题:
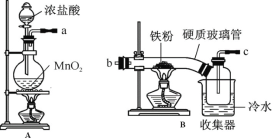
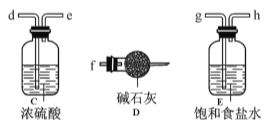
(1)装置的连接顺序为 (用a 、b、c…h表示)。
(2)i.A装置中反应的化学方程式为 。
ii.D中碱石灰的作用是 。
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得FeCl3进入收集器,需进行的操作是 。
(4)FeCl3溶液常用于吸收有毒气体H2S。反应的离子方程式为 。
(5)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(过程中不振荡),充分反应后,进行如下实验:

淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为 。
(6)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
根据上述实验得出溶液褪色的原因是: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
(1)降低温度,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是

(3)据图判断,反应进行至20min时,曲线发生变化的原因 (用文字表达)
(4)10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3的物质的量
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,G为黄绿色气体单质,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。

请回答下列问题:
(1)写出E、H的化学式:E ,H 。
(2)写出①、⑤的化学方程式:
① ,⑤ 。
(3)写出③的离子方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤的直接燃烧会对大气造成严重污染,是雾霾形成的一个重要原因。实现煤的清洁利用迫在眉睫。乙醇、甲醇、尿素等均与煤化工相关。
Ⅰ.(1)将煤转化成水煤气可有效提高能源利用率:
C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
(2)一定温度下,在体积可变的容器中投入反应物进行此反应,则下列说法正确的是
A.体系中加入催化剂(其他条件保持不变),平衡不移动但反应的ΔH 将变大
B.若正、逆反应比值恒定,则说明平衡已建立
C.建立平衡后,加压,气体的平均相对分子质量将增大
D.建立平衡后,加压,平衡向逆方向移动,平衡常数减小
Ⅱ.乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
在一定压强下,测得上述反应的实验数据如下表。
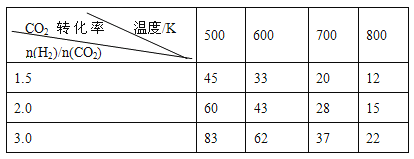
根据表中数据分析:
(3)上述反应的a 0(填“>”“<”或“=”)
(4)在温度为T1时,该反应的平衡常数K=1,在2L密闭容器中加入一定量体系各物质,反应的某时刻测得反应体系中各气体均为1mol。
①此时V(CO2)正= V(CO2)逆(填“>”“<”或“=”)
②若反应在恒压绝热容器中进行,达平衡后,CO2的物质的量
A.大于1mol B.等于1mol C.小于1mol D.不确定
Ⅲ.CO2亦是合成尿素的重要原料,以CO2与NH3为原料合成尿素[化学式为[CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) ΔH=+l59.5kJ·mol-1
②NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 氯乙烯和溴乙烷均能发生加成反应
B. 花生油和玉米油都是可皂化的饱和酯类
C. 天然气和水煤气的主要成分都是烃类
D. 分子式为C10H14的单取代芳烃,其可能的结构有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com