
科目: 来源: 题型:
【题目】下列说法中,正确的是( )
A. 活化分子间的碰撞一定是有效碰撞
B. 其他条件相同时,增大反应物浓度,反应物中活化分子的百分数增加
C. 焓变和熵变都与反应的自发性有关,它们都能独立地作为自发性的判据
D. 常温下,FeCl3溶液中由水电离出的c (H+)一定大于1×10﹣7mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作正确的是
A. pH试纸直接蘸取NaOH溶液测定其pH
B. 存放化学品的仓库失火后,尽快用水灭火
C. 蒸馏时,加热一段时间后,再投入沸石
D. 切割剩下的白磷放回原试剂瓶水封保存
查看答案和解析>>
科目: 来源: 题型:
【题目】人体内所含微量元素是指总含量不到万分之一,而质量总和不到人体质量千分之一的20多种元素,这些元素对人体正常代谢和健康起着重要作用。下列元素肯定不属于人体微量元素的是( )
A.I B.O C.Fe D.Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气中的SO2和O2接触时,SO2会部分转化为SO3,使空气的酸度增加,飘尘所起的作用可能是( )
A.氧化剂 B.还原剂 C.催化剂 D.载体
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法不正确的是
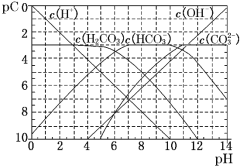
A.某温度下,CO2饱和溶液的浓度是0.05 molL-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1 mol·L-1Na2CO3中c(HCO3﹣)比0.1 mol·L-1NaHCO3中c(HCO3﹣)大
查看答案和解析>>
科目: 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH+4、Fe2+、Fe3+、CO2-3、SO2-3、SO2-4、Cl-、NO-3中的一种或几种,取该溶液进行连续实验,实验内容如下:
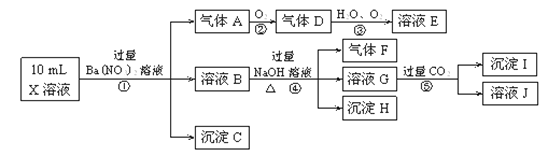
根据以上信息,回答下列问题:
(1)反应③的化学方程式为________________________。
(2)沉淀C、H和气体F的化学式分别为____________________。
(3)写出有关反应的离子方程式:
①中生成A_____________________。⑤________________________。
(4)上述离子中,溶液X中肯定不含有的离子是_______________,可能含有的离子是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在与外界隔离的体系中,自发过程将导致体系的熵 ,(填“增大”、“减小”、“不变”);对于同一种物质, 时熵值最大。(填“固态”、“液态”、“气态”)
(2)某工厂实验室用CO和H2制备CH3OH,其原理为:CO(g)+2H2(g) ![]() CH3OH(g) △H < 0该温度下的化学平衡常数表达式_____________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)
CH3OH(g) △H < 0该温度下的化学平衡常数表达式_____________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)
(3)M与N是同素异形体,由M=N;△H=+119KJ/mol可知,M比N________(填稳定、不稳定)
(4)一定温度下,反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后, 保持压强不变,充入Ar,其正反应速率__________(A.变快 B.不变 C变慢,填字母代号);该反应向__________(填正移、逆移或不移)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅孔雀石是一种含铜矿石,含铜形态为CuCO3Cu(OH)2和CuSiO32H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:

(1)完成步骤①中稀硫酸与CuSiO32H2O反应的化学方程式:
CuSiO32H2O+H2SO4=CuSO4+_______+H2O;双氧水的作用是______________。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A.CuO B.Fe2O3 C.Al2O3 D.Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为______________,滤液B中除Cu2+外,还含有的金属阳离子是______________。
(4)将滤液B通过______________、______________,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______________中灼烧。加热失水后,若在空气中冷却称量,测定结果______________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com