
科目: 来源: 题型:
【题目】铁及其化合物在日常生活中用途比较广泛。
(1)高铁酸钠(Na2FeO4)是一种新型的绿色消毒剂和高容量电池材料。将Fe(NO3)3与NaClO混合后,在碱性条件下发生反应可制得高铁酸钠,该反应的离子方程式为________________________。
(2)四氧化三铁(Fe3O4)常用作颜料、磁流体材料、催化剂和电子材料等。共沉淀法是目前制备纳米Fe3O4的重要方法之一,其流程如图所示:

①为得到较纯净的纳米Fe3O4,FeSO4·7H2O与FeCl3·6H2O的物质的量之比最好为________。但实际操作时,却很难控制这一比例,原因是_____________________________。
②在最佳投料比条件下,检验Fe3O4是否沉淀完全的实验操作是_________________________。
(3)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。测定绿矾产品中FeSO4·7H2O含量的方法如下:
a.称取3.0 g绿矾产品,配制成250.00 mL溶液;
b.量取25.00 mL a中溶液于锥形瓶中;
c.用0.010 00 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液的平均体积为20.00 mL。滴定时发生反应的离子方程式为5Fe2++MnO![]() +8H+===5Fe3++Mn2++4H2O。
+8H+===5Fe3++Mn2++4H2O。
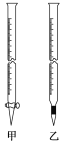
①0.010 00 mol·L-1KMnO4溶液应置于如图所示仪器________(填“甲”或“乙”)中,滴定终点的现象是__________________________________。
②产品中FeSO4·7H2O的质量分数为________(小数点后保留1位数字)。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),可能的原因有___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2 H2(g) ![]() CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是( )
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是( )

A.T1 > T2
B.该反应的ΔH > 0
C.T1时的平衡常数K1 < T2时的平衡常数K2
D.T1时的平衡常数K1 > T2时的平衡常数K2
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年8月12日晚11时,天津港国际物流中心区域内化学危险品仓库因起火而发生爆炸。其仓库存储的桶装氰化钠,因爆炸冲击发生了泄漏。氰化钠是一种重要的基本化工原料,用于电镀、冶金等,因此很多工业废水中也含氰化钠,此工业废水可与其他工业废水一同处理。下图是工业上处理含铬废水和含氰废水的流程图:
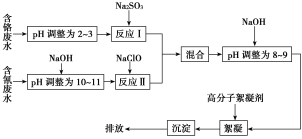
(1)含铬废水中的铬元素主要以CrO![]() 形式存在,酸化时CrO
形式存在,酸化时CrO![]() 可转化为Cr2O
可转化为Cr2O![]() ,现象是__________________________。
,现象是__________________________。
(2)酸性条件下,Cr2O![]() 极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为__________________________。
极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为__________________________。
(3)①在爆炸发生时有少量氰化钠炸出,有人指出可用双氧水处理,使之被氧化成无毒物质,已知二者反应生成一种烘焙时常用的物质,并释放出一种有刺激性气味的气体,该气体易液化,液化后常用作制冷剂,请写出氰化钠与过氧化氢反应的化学方程式:________________________。
②除双氧水外,还可用硫代硫酸钠处理氰化钠,转化为Na2SO3及弱毒性的NaSCN,写出两种物质发生反应的化学方程式:__________________。
(4)pH>10时,“反应Ⅱ”中的NaClO可将氰离子(CN-)快速氧化为两种无毒的物质,写出该反应的离子方程式:_____________________________。
(5)经过“反应Ⅰ”和“反应Ⅱ”的两种废水“混合”的目的是____________________。
向混合后的溶液中加NaOH调为碱性的目的是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
B.0.1 mol/L NH4Al(SO4)2溶液与0.2 mol/L Ba(OH)2溶液等体积混合:Al3++2SO![]() +2Ba2++4OH-=2BaSO4+AlO
+2Ba2++4OH-=2BaSO4+AlO![]() +2H2O
+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() +6H++5H2O2=2Mn2++5O2↑+8H2O
+6H++5H2O2=2Mn2++5O2↑+8H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O===HClO+HSO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 所有的烷烃都是同系物
B. 在适合的条件下,含有双键的分子都能发生加成反应
C. 用Br2的CCl4溶液或酸性KMnO4溶液都可以区别烯烃和芳香烃
D. 戊烷有三种同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 石油的裂解可以提高汽油等轻质油的质量和产量
B. 在一定条件下煤和氢气作用得到液体燃料的过程是煤的液化途径之一
C. 石油气通入溴水中不能使溴水褪色
D. 煤焦油经过分馏可以获得苯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.含有大量Ba2+的溶液中:Cl、K+、SO42﹣、CO32﹣
B.含有大量H+的溶液中:Mg2+、Na+、HCO3﹣、SO42﹣
C.含有大量OH﹣的溶液中:NH4+、NO3、SO42﹣、CO32﹣
D.含有大量Na+的溶液中:H+、K+、SO42﹣、NO3﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式或电离方程式正确的是( )
A.NaHSO3溶液呈酸性:NaHSO3=Na++H++SO![]()
B.向Na2SiO3溶液中通入少量CO2:SiO![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO![]()
C.将一小块钠投入稀醋酸中:2Na+2H+=2Na+H2
D.在Na2S2O3溶液中滴加稀硝酸:2H++S2O![]() =S+SO2+H2O
=S+SO2+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ | Na+ | Cu2+ | Al3+ |
阴离子 | SO | HCO | NO | OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B________,D________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为________。
(3)C常用作净水剂,用离子方程式表示其净水原理:_________________________。
(4)在A溶液中加入少量澄清石灰水,其离子方程式为________________________。
(5)向20 mL 2 mol/L C溶液中加入30 mL E溶液,充分反应后得到0.78 g沉淀,则E溶液中溶质的物质的量浓度是________ mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个体积均为1.0 L的恒容密闭容器中,充入一定量的H2和SO2发生下列反应:3 H2(g) + SO2(g)![]() 2 H2O(g) + H2S(g),下列说法正确的是( )
2 H2O(g) + H2S(g),下列说法正确的是( )
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
H2 | SO2 | H2 | SO2 | ||
容器Ⅰ | 300 | 0.3 | 0.1 | 0.02 | |
容器Ⅱ | 300 | 0.6 | 0.2 | ||
容器Ⅲ | 240 | 0.3 | 0.1 | 0.01 | |
A.该反应正反应为吸热反应
B.容器Ⅲ达到平衡的时间比容器I短
C.240℃时,该反应的平衡常数为1.08×104
D.容器Ⅱ达到平衡时SO2的转化率比容器I小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com