
科目: 来源: 题型:
【题目】—定条件下,对于可逆反应X (g) +3Y (g) ![]() 2Z (g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),达到平衡时,X、Y、Z的浓度分別为0.lmol/L、0.3mol/L、 0.08mol/L,则下列判断正确的是
2Z (g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),达到平衡时,X、Y、Z的浓度分別为0.lmol/L、0.3mol/L、 0.08mol/L,则下列判断正确的是
A.c1:c2=3:1 B.平衡时,Y和Z的生成速率之比为2: 3
C.X、Y的转化率相等 D.c1的取值范围为0.04mol/L<c1<0.14mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3,流程图如下。
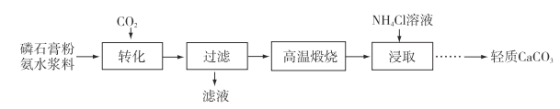
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见如下图。清液pH>11时CaSO4转化的离子方程式为________;能提高其转化速率的措施有________(填序号)。

A.搅拌浆料
B.加热浆料至100 ℃
C.增大氨水浓度
D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为________和__________(填化学式);检验洗涤是否完全的方法是_____________________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】依据国家相关法律规定,机动车驾驶员醉驾将受到刑事处罚.检测驾驶员是否酒后驾车,可用一种装有重铬酸钾(K2Cr2O7)的仪器.在K2Cr2O7中Cr元素的化合价是( )
A.+2
B.+3
C.+6
D.+7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B. HClO是弱酸,所以NaClO是弱电解质
C. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D. 杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组设计研究铜和稀硝酸反应速率V(NO)的实验。试回答下列问题:
(1)写出铜和稀硝酸反应的离子方程式___________________。
(2)为测定铜和稀硝酸反应速率v(NO),本实验需要记录的实验数据为:______________、___________。
(3)该兴趣小组间学对实验数据进行处理后得到用NO表示铜和稀硝酸的反应速率和时间的关系图如图所示.則:
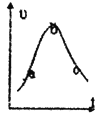
a—b,v(NO)变化的主要原因是___________________。
b→c,v(NO)变化的主要原因是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图。
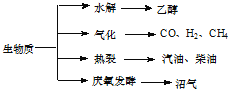
(1)下列有关说法正确的是
A.生物质能,本质上能量来源于太阳能
B.由纤维素水解获得的乙醇属生物质能
C.生物质裂解获得的汽油、柴油等属于纯净物
D.由植物秸秆等发酵获得的沼气,主要成分是甲烷
(2) 由生物质能获得的CO和H2,当两者1: 1催化反应,其原子利用率达100%,合成的物质可能是________。
A.汽油 B.甲醇 C.甲醛(HCHO) D.乙酸
(3) 已知在生物质气化炉中可发生:
C(s)+CO2(g)═2CO(g);△H=+172kJ/mol
CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206kJ/mol
CH4(g)+2H2O(g)═CO2(g)+4H2(g);△H=+165kJ/mol
则C(s)+H2O(g)═CO(g)+H2(g);△H=____________kJ/mol.
(4)由生物质能获得的CO和H2可以用来合成液态燃料甲醇,实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(5) 己知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原是一类重要的反应。
(1)已知反应Cu+2Fe3+=Cu2++2Fe2+,反应中还原剂是 ,氧化性Fe3+ Cu2+(填“ < ”或“ > ”) 。
(2)在2Na2O2+2CO2=2Na2CO3+O2反应中,若转移3mol电子,则所产生的氧气在标准状况下的体积为 L。
(3)在xR2++yH++O2═mR3++nH2O的离子方程式中,对系数m和R2+、R3+判断正确的是 。
A.m=y,R3+是还原剂 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(4)用双线桥标出反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中电子转移的方向和数目。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。
(1)查阅资料知,NaHSO3与过量KIO3反应分为两步进行,第一步为IO![]() +3HSO
+3HSO![]() ===3SO
===3SO![]() +3H++I-,则第二步反应的离子方程式为________________________。
+3H++I-,则第二步反应的离子方程式为________________________。
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的反应速率的影响。调节反应物浓度和温度进行对比实验,记录如下:
实验编号 | 0.02 mol/L NaHSO3溶液/mL | 0.02 mol/L KIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
① | 15 | 20 | 10 | 15 | t1 |
② | a | 30 | 0 | 15 | t2 |
③ | 15 | b | c | 30 | t3 |
实验①②是探究____________对反应速率的影响,表中a=________;实验①③是探究温度对反应速率的影响,则表中b=________,c=________。
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO![]() 对反应起催化作用,SO
对反应起催化作用,SO![]() 浓度越大反应速率越快;
浓度越大反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
假设三:__________________________;
……
(4)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色。
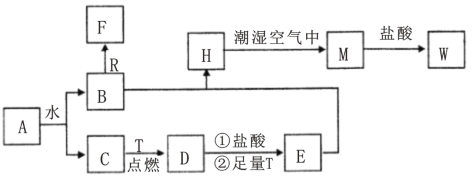
(1)物质D的化学式为___________,E化学式为___________;
(2)点燃气体F前必须先_________________________;
(3)H在潮湿空气中变成M的实验现象是_______________,化学方程式为_______________,其反应类型是 反应(填基本反应类型)。
(4)B和R在溶液中反应生成F的离子方程式为____________________,该反应属 反应 (填基本反应类型)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com