
科目: 来源: 题型:
【题目】填空
(1) 把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______________;欲除去CuSO4溶液中的铁离子可加入___________(填物质的化学式,一种即可);
(2) CuSO4的水溶液呈酸性,原因是(用离子方程示)____________;
(3) 泡沫灭火器原理(用离子方程式示)________________;
(4) 铵态氮肥不能与草木灰混施(用离子方程式表示)_______________;
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有 4种(不考虑立体异构)
的一溴代物都有 4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物![]() 的名称是 2,3,4-三甲基-2-乙基戊烷
的名称是 2,3,4-三甲基-2-乙基戊烷
D. ![]() 和
和![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填空:
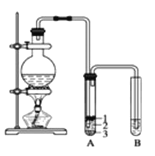
(1)盛放反应物的仪器名称是________,其中加入的反应物是溴化钠、 和 1∶1的硫酸。
(2)将生成物导入盛有冰水混合物的试管 A中,冰水混合物的作用是_____________。试管 A中的物质分为三层(如图所示),产物在第___________层。
(3)试管 A中除了产物和水之外,还可能存在_________、________(写出化学式)。
(4)用浓的硫酸进行实验,若试管 A中获得的有机物呈棕黄色,除去其中杂质的正确方法是______(选填编号)。
a.蒸馏
b.用氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
(5)若试管 B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.元素的种类由最外层电子数决定
B.化学键是存在于分子、原子和离子间的作用力
C.原子的种类由原子核内质子数与中子数共同决定
D.化学反应速率可以决定反应的限度
查看答案和解析>>
科目: 来源: 题型:
【题目】以下说法正确的是 ( )
A. 物质所含元素化合价升高的反应叫还原反应
B. 在氧化还原反应中,失去电子的元素化合价降低
C. 物质中某元素失去电子,则此物质是氧化剂
D. 还原剂中必定有一种元素被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙.
[查阅资料]
氢化钙通常用氢气与钙加热制得.
氢化钙要密封保存,遇水反应生成氢氧化钙和氢气.
钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热.
标准状况下氢气的密度为0.09g/L.
[进行实验]小组同学设计的制取装置如图所示(固定装置略).

回答下列问题:
(1)写出A中发生反应的化学方程式______________________________.
(2)B、D中所盛试剂相同,该试剂为_____________,其作用分别是____________________、___________________________.
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是__________________.
(4)装置C中制取氢化钙的化学方程式是______________________.
[实验反思]小组同学通过反思提出问题:上述制得的氢化钙是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量的氢化钙样品,按图所示连接仪器(固定装置略).

步骤2:将Y形管倾斜,使A中的水全部进入B中,完全反应后,冷却至室温,读取量筒读数.
(5)通过上述实验可分析出制得的氢化钙是否纯净,其依据是______________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
已知①常压下反应的能量变化如图所示。

②
③CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
(4)在________(填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(5)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH )3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如右图所示。

①写出甲池的A极电极反应式:______________________。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的_______。
A.H2SO4
B.BaSO4
C.Na2SO4
D.NaOH
E.CH3CH2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应 3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2NO↑+ 4H2O,以下叙述正确的是( )
A. 氧化剂和还原剂的物质的量比为8: 3
B. 被还原的HNO3和起酸性作用的HNO3的物质的量的比为2∶3
C. 该反应的电子转移数为6e-
D. 该反应中Cu(NO3)2 为氧化产物,H2O为还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com