
科目: 来源: 题型:阅读理解

| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目: 来源: 题型:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cr(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.5 | 4.3 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 5.6 | 5.2 |
| +6 |
| Cr |
查看答案和解析>>
科目: 来源: 题型:
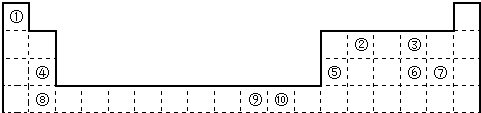
 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)

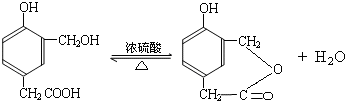

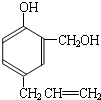

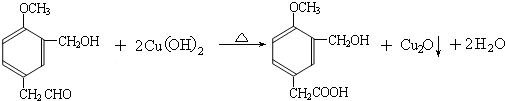

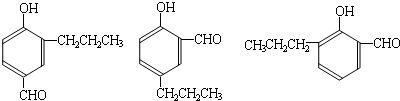

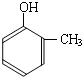 到的合成
到的合成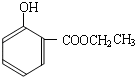 路线(用合成路线流程图表示,并注明反应条件).
路线(用合成路线流程图表示,并注明反应条件).| 浓H2SO4 |
| 170℃ |
| 高温、高压 |
| 催化剂 |

查看答案和解析>>
科目: 来源: 题型:阅读理解
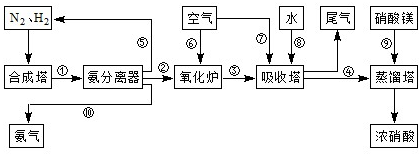
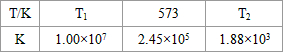
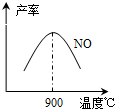 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因查看答案和解析>>
科目: 来源: 题型:
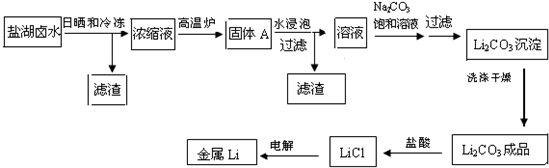
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目: 来源: 题型:
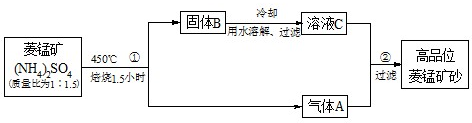
| ||
| c(Ba2+) |
| c(Mn2+) |
查看答案和解析>>
科目: 来源: 题型:阅读理解
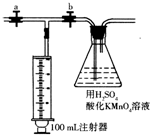
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com