
科目: 来源: 题型:
【题目】PC 是一种可降解的聚碳酸酯类高分子材料,具有广泛应用,其结构简式为:
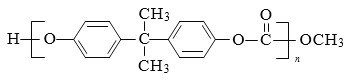 。一种生产 PC 的合成路线如下:
。一种生产 PC 的合成路线如下:
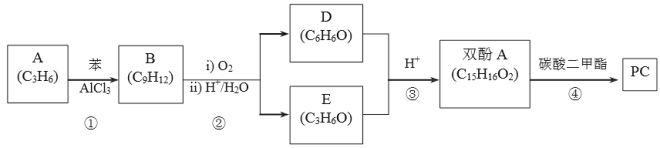
其中,A 可使 Br2 的 CCl4 溶液褪色,B 中有五种不同化学环境的氢,D 可与 FeCl3 溶液发生显色反应;E 可与 H2 发生加成反应,其核磁共振氢谱为单峰。
已知: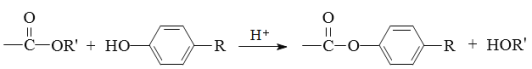
请回答下列问题:
(1)D 中官能能团名称 ,A 的结构简式是 ,A 与 Cl2 反应的产物名称是 ,B 的结构简式是 。
(2)第③步反应的化学方程式是 。
(3)碳酸二甲酯的一种同分异构体名叫乳酸,该物质能发生的化学反应有 (填字母)。
a. 取代反应 b. 加成反应 c. 消去反应 d. 加聚反应
(4)碳酸二甲酯有多种同分异构体,写出其中能与 Na2CO3 溶液反应的任意一种同分异构体结构简式 (乳酸除外)
(5)第④步反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业为人类解决粮食问题做出了巨大贡献.一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g)2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是( )
A. N2、H2完全转化为NH3 B. N2、H2、NH3在容器中共存
C. 反应已达到化学平衡状态 D. N2、H2、NH3的浓度不再改变
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸的酸性比硅酸强,某化学课外小组搜集了大量的证据证明硅酸的酸性弱于碳酸酸性。其中能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸钙、碳酸钠等固体反应生成CO2
D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列条件下,一定能大量共存的离子组是
A.无色透明的水溶液中:K+、Mg2+、I-、MnO4-
B.有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I-
C.在强碱溶液中:Na+、K+、CO32-、NO3-
D.在强酸性溶液中:K+、HCO3-、SO42-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NaCl、Na2SO4、Na3PO4三种溶质的物质的量浓度之比是1:1:2,三种溶液的体积比为2:2:1,则这三种溶液中Na+个数比是
A.1:3:6
B.2:3:9
C.9:3:1
D.1:2:3
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列氧化还原反应中,水既不作氧化剂又不作还原剂的是()
①2Na+2H2O=2NaOH+H2↑
②2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
③2F2+2H2O=O2+4HF
④3NO2+H2O=2HNO3+NO
⑤NaH+H2O=NaOH+H2↑
⑥2Na2O2+2H2O=4NaOH+O2↑
A. ③④⑥ B. ②③⑤ C. ①②③⑤ D. ④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
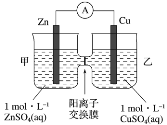
A.锌电极上发生还原反应
B.电池工作一段时间后,甲池的 c(SO42-)不变
C.电池工作一段时间后,乙池溶液的总质量减少
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验.
(1)气体发生装置中反应的化学方程式是 。
(2)实验室常用排饱和食盐水的方法来收集 Cl2,试用化学平衡原理加以解释 .
以下甲学生对 Cl2 与 FeCl2 和 KSCN 混合溶液的反应进行实验探究。
(3)A 中溶液变红的原因是 。
(4)为了探究现象 II 的原因,甲同学进行如下实验。
①取 A 中黄色溶液于试管中,加入 NaOH 溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取 A 中黄色溶液于试管中,加入过量的 KSCN 溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是 SCN-与 Cl2发生了反应。
(5)甲同学猜想 SCN-可能被 Cl2氧化了,他又进行了如下研究。
资料显示:SCN-的电子式为![]()
①甲同学认为 SCN-中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的 BaCl2 溶液,产生白色沉淀,由此证明 SCN-中被氧化的元素是 (填名称)。
③通过实验证明了 SCN-中氮元素转化为NO3-,他的实验方案是 。
④若 SCN-与Cl2反应生成CO2,写出反应离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组根据SO2的性质进行如下相关实验研究。

【制备SO2】按照如图装置制备SO2。
(1)A试管中可观察到的现象是 ;SO2具有漂白性,试再举出两种漂白原理互不相同的物质 。
(2)若A试管中只加浓硫酸,加热过程中,导管b出口处的气体遇见潮湿的空气会有少量“酸雾”产生。推测b处出现酸雾的主要化学反应方程式为 。
(3)SO2尾气可以用浓氨水吸收。实验室制备NH3的化学方程式为__________;下列装置中宜用于NH3制备浓氨水的是 (填序号)。


【SO2浓度检测】
(4)学生用ME3 - SO2型电化学传感器测量试管B中SO2气体浓度,工作原理如右图。电极Ⅱ的反应式为 ;当通入VmL气体时,测得SO2浓度为amol/L。此时电解液中生成的n(H+)为 ;电化学传感器灵敏度受温度影响。若高于工作温度时,测得SO2,浓度可能偏低,其原因可能是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com