
科目: 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
Ⅰ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
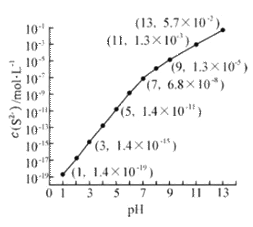
Ⅱ.在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(Q>0)
2SO3(g)(Q>0)
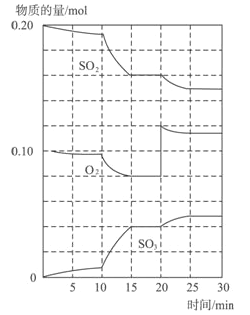
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____________。
(2)据图判断,反应进行至20min时,曲线发生变化的原因是______________(用文字表达)10min到15min的曲线变化的原因可能是______________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.
查看答案和解析>>
科目: 来源: 题型:
【题目】将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为( )
A. 0.05 mol B. 1 mol C. 1.05 mol D. 0.13 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生成在一起,故有“生命金属”之称。下列有关4822Ti和5022Ti的说法正确的是
A. 质量数相同,互为同位素
B. 质子数相同,互为同位素
C. 中子数相同,属同一种元素的不同核素
D. 核外电子数相同,中子数不同,不能互称为同位素
查看答案和解析>>
科目: 来源: 题型:
【题目】合金有许多特点,如Na-K合金为液体,而Na和K的单质均为固体。据此,试推测:生铁、纯铁、碳三种物质中,熔点最低的是( )
A.纯铁
B.生铁
C.碳
D.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
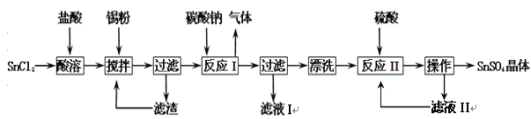
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易水解,易被氧化。某研究小组设计SnSO4制备路线如下:
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是 ;
(2)反应I得到的沉淀是SnO,得到该沉淀的离子方程式是 ;
(3)在反应I得到沉淀SnO后,要进行“过滤”、“漂洗”,检验SnO是否洗涤干净的操作是 ;
(4)反应II之后的“操作”依次为 、 、过滤、洗涤、低温干燥;
(5)某化学兴趣小组对用于微电子器件生产的锡粉进行了纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3溶液;③用0.2000 mol/L 酸性K2Cr2O7溶液滴定(产物中Cr呈+3价)至终点,消耗K2Cr2O7溶液15.00 mL。写出酸性K2Cr2O7溶液滴定的离子方程式 ,则此锡粉样品中锡的质量分数为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com