
科目: 来源: 题型:
【题目】某工厂拟综合处理含NH4-废水和工业废气(主要含N2、CO2、.SO2、NO、CO,不考虑其它成分),设计了如下流程:
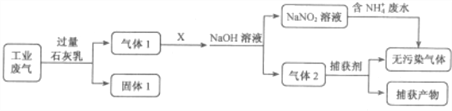
已知:NO+NO2+2NaOH=2NaNO2+H2O
回答下列问题:
(1)固体1的主要成分Ca(OH)2、CaCO3和______。
(2)气体X与气体1反应时起到的作用是______(填“氧化剂”、“还原剂”或“即不是氧化剂也不是还原剂”),捕获剂所捕获的气体主要是______ (填化学式)。
(3) NaOH溶液吸收等物质的量的NO、NO2气体过程中,当生成1molNaNO2时转移电子数为_______NA。
(4)用NaNO2溶液处理含NH4-废水时,发生反应的离子方程式为__________;含NH4-废水也可用沉淀法处理:Mg2++NH4- +PO43-=== MgNH4PO4↓, 已知25℃时,Ksp(MgNH4PO4)=2.5×10-13 。向废水中按比例投入镁盐和磷酸盐,欲使沉淀后废水中残留的铵态氮达到一级排放标准(≤1.0mg·L-1,即≤7.14×10-5 mol·L-1),且c(PO43-)=1.0×10-5 mol·L-1,则应使沉淀后的废水中c( Mg2+) ≥________。
(5)电化学氧化法是处理氨氮废水的一种新工艺。间接电氧化的原理是:向废水中加入一定量的氯离子,使其电解时在阳极放电生成氯单质,利用氯单质与水反应生成的次氯酸将NH4+氧化 为氮气。最后一步反应的离子方程式为__________________________。
(6) 已知25℃时,HNO2的电离常数Ks =5.1×10-4。实验室常用NaOH溶液吸收NO2尾气,反应为2NO2+ 2NaOH==NaNO3+ NaNO2+H2O。若用1L 0.4 mol·L-1Na(OH)溶液充分吸收0.4mol NO2气体,则所得溶液显___(填“酸性”、“碱性”或“中性”),原因是___________(用离子方程式表示);忽略溶液体积变化,近似计算所得溶液的pH≈____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 煤、石油和天然气都是清洁能源
B. 所有的燃烧反应都是放热反应
C. 生活和生产中最常用的燃料里所含的主要元素为氧元素
D. 从能量角度看,断开化学键会释放能量,形成化学键会吸收能量
查看答案和解析>>
科目: 来源: 题型:
【题目】在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6 gX与Y完全反应后,生成4.4 gR,则 在此反应中,Y与R的化学式量之比为:
A.32: 18 B.16:11 C.8:11 D.16:9
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示,ΔH1=-393.5 kJmol-1,ΔH2=-395.4 kJmol-1,下列说法或表示式正确的是( )

A.C(s,石墨)= C(s,金刚石) ΔH= +1.9 kJmol-1
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1molL-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
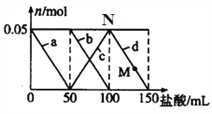
A. b和c曲线表示的是同一个离子反应
B. N点时生成的CO2为0.05mol
C. M点时Al(OH)3的质量等于3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1 :1
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学一选修3:物质结构与性质】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为 +7价 | 基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1) W的基态原子电子排布式为____, X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5 (气态或液态时)中,中心原子的轨道类型不是sp3杂化的是________(填化学式,下同),分子构型是正四面体的是______, 属于极性分子的是____。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为____,Y与氢元素能形成YnH2n+2 (n为正整数)的一系列物质,这一系列物质沸点的变化规律以及影响的因素是______________。
(4)Z可形成多种含氧酸,如H3ZO4、HZO3、H3ZO3等,其中酸性最强的是______(填化学式)。
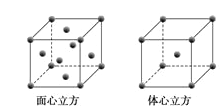
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为r cm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为_____gcm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有0.1 mol·L-1醋酸溶液10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是
①电离程度增大 ②c(CH3COOH)增大 ③CH3COO-数目增多 ④c(H+)增大
⑤导电性增强 ⑥![]() 增大 ⑦c(OH-)增大
增大 ⑦c(OH-)增大
A.①②③⑦ B.①③⑤⑥ C.①③⑥⑦ D.②④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意回答问题:
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+) 盐酸溶液中的c(H+)(填“>”、“=”或“<”)。
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸 盐酸(填“>”、“=”或“<”)。
③使温度都升高20℃,溶液中c(H+):醋酸 盐酸(填“>”、“=”或“<”)。
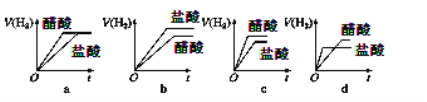
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是 (填字母)。
(2)下图是电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图像字母填写在下列横线上。
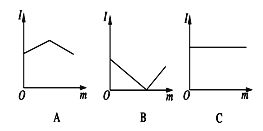
①氢氧化钡溶液中滴入硫酸溶液至过量 。
②醋酸溶液中滴入氨水至过量 。
③澄清石灰水中通入CO2至过量 。
(3)已知下表中的电离平衡常数,回答问题

① HSO![]() 的电离平衡常数表达式为: 。
的电离平衡常数表达式为: 。
② H2SO3溶液与NaHCO3溶液反应的主要离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com