
科目: 来源: 题型:
【题目】已知H-H键能为436KJ/mol,H-N键能为391 KJ/mol,根据热化学方程式N2(g) +3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。则N≡N的键能约为( )
2NH3(g) △H=-92.4kJ/mol。则N≡N的键能约为( )
A.431 kJ/mol B.946 kJ/mol C.649 kJ/mol D.896 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的。
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为_____________________________________。
(2)脱硫:①某种脱硫工艺将废气处理后可获得硫酸铵和硝酸铵,物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的c(NH4+)与后者的c(NH4+)的关系是__________。
A.大于2倍 B.等于2倍 C.介于2倍与2倍之间 D.小于1倍
②25℃时pH均为4的硝酸铵溶液和稀硝酸中由水电离出的氢离子浓度分别为c1、c2 ,则c1与c2的比值等于_______。
(2)脱碳:废气中的CO2转化为甲醇(CH3OH)可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液.电极c上发生的电极反应式为____,当电池中有1mole-发生转移时左右两侧溶液的质量之差为___g (假设反应物a、b耗尽,忽略气体的溶解)。
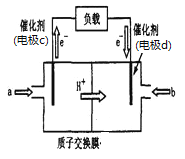
查看答案和解析>>
科目: 来源: 题型:
【题目】右图中的曲线是表示其他条件一定时,2NO+O2![]() 2NO2 △H<0 ,反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2 △H<0 ,反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是

A. a点 B. b点 C. c点 D. d点
查看答案和解析>>
科目: 来源: 题型:
【题目】离子键的强弱主要决定于离子半径和离子电荷数,一般规律是:离子半径小,离子所带电荷值大,则离子键越强.①K2O ②MgO ③CaO三种物质离子键由强到弱的顺序是( )
A.K2O,MgO,CaO
B.MgO,CaO,K2O
C.MgO,K2O,CaO
D.CaO,K2O,MgO
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是

A. 化合物XZ3中各原子均满足8电子的稳定结构
B. X、Y、Z三种元素形成的含氧酸都是强酸
C. 常温下,Z单质可与Y的氢化物发生置换反应
D. 一定条件下,X2与Al反应得到AlX
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NOx、CO等大气污染物的测量及处理具有重要意义。
(1)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。NOx在催化转化器中被CO还原成N2排除。写出NO被CO还原的化学方程式:________________。
(2)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-905.5kJmol-1
4NO(g)+6H2O(g)△H=-905.5kJmol-1
N2(g)+O2(g)![]() 2NO(g)△H=+180kJmol-1
2NO(g)△H=+180kJmol-1
完成该方法中主要反应的热化学方程式
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=_________________。
4N2(g)+6H2O(g)△H=_________________。
②该方法应控制反应温度在315~400℃之间,反应温度过低会影响反应速率,但温度也不宜过高,原因是___________________。
③氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物x的转化率与氨氮比的关系如右图所示,则X是________________ (填化学式)。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是________________ 。

(3)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是______________反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )
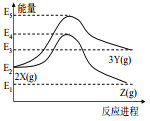
A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
查看答案和解析>>
科目: 来源: 题型:
【题目】环境问题已经成为世界上越来越重要的议题,其中大气污染主要有硫的氧化物和氮的氧化物,工业生产是其原因之一,同时工业上通常也用下列方法来治理污染。
(1)烟气中含有SO2等大量有害的物质,烟气除硫的方法有多种,其中石灰石法烟气除硫工艺的主要反应如下:
Ⅰ.CaCO3(s)= CO2(g)+CaO(s) △H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)=CaSO3(s) △H=﹣402kJ/mol
Ⅲ.2CaSO3(s)+O2(g)+4H2O(l)=2[CaSO42H2O](s) △H=﹣234.2kJ/mol
试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式 .
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气体3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)氨催化氧化是硝酸工业的基础,反应原理为:4NH3(g)+5O2(g)4NO(g)+6H2O(g)实际生产中,还会发生此反应:4NH3+3O2N2+6H2O,在1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中,有关温度与各物质的量关系如图1所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x= 。
②NH3生成N2的反应属于 (填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是 。
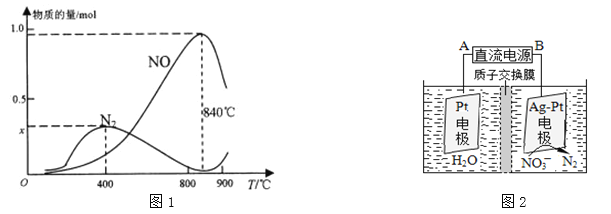
(4)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO![]() 的原理如图2所示,阴极反应式为 。假设降解前两极溶液质量相等,当电路中有2mol电子通过时,此时两极溶液质量的差值为 g。
的原理如图2所示,阴极反应式为 。假设降解前两极溶液质量相等,当电路中有2mol电子通过时,此时两极溶液质量的差值为 g。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请用化学方程式解释下列现象:
①硝酸久置成黄色的原因:___________________________________________
②氨气溶于水使无色酚酞变红的原因: _____________________________________
(2)铁粉与过量的稀硝酸常温下可以发生如下反应:
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
当铁粉过量时,在标准状况下反应生成2.24LNO气体,反应后溶液的溶质为________,则一共有______g铁参加反应,被还原的HNO3与未被还原的硝酸物质的量之比等于______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com