
科目: 来源: 题型:
【题目】在密闭容器里,A与B反应生成C,其反应速率分别用υA、υB、υC表示,已知:υA=3υB、2υA=3υC,则此反应可表示为
A. 2A+3B=2C B. A+3B=2C C. 3A+B=2C D. A+B=C
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物0.1摩和标准状况下的氧气5.6升恰好反应完全,所得产物为CO2、CO、H2O(气),产物通过盛浓硫酸的洗气瓶,洗气瓶的质量增加了5.4克,再通过足量灼热的氧化铜,氧化铜的质量减轻了1.6克,再通过装有碱石灰的干燥管,干燥管增加了8.8克。
(1)求有机物的分子式,
(2)若此有机物能与钠反应,写出其结构简式。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿色化学”实验已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠的反应实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A.②③④
B.①②③
C.①②④
D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】【2014新课标2】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
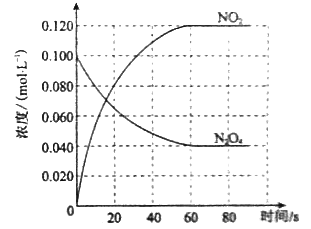
回答下列问题:
(1)反应的△H 0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 molL-1s-1;反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
a:T 100℃(填“大于”或“小于”),判断理由是 。
b:列式计算温度T时反应的平衡常数K2 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中错误的是( )
A.分类是学习和研究化学物质及其变化的一种常用方法
B.有些液态胶体也是透明的,用肉眼很难与溶液相区别
C.2L1 mol/L Na2CO3溶液中 c (Na+)为4 mol/L
D.从1LNaCl溶液中取出100 ml,其浓度与原lL溶液相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.升高温度或加入催化剂,可以改变化学反应的反应热
B.电解池是化学能转变成电能的装置
C.将碘酒滴在馒头上,可观察到馒头变蓝色
D.葡萄糖、淀粉、蛋白质均属于高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各种微粒在水溶液中能大量共存的是
A. Ba2+、Na+、CO32-、NO3- B. H+、K+、I-、ClO-
C. Fe2+、Al+、NO3-、HCO- D. Cu2+、Fe2+、SO42-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除去杂质的操作方法正确的是( )
A.NO中有少量的NO2:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C.N2中有少量的O2:通过足量灼热的氧化铜
D.硝酸中溶有少量NO2 , 可向硝酸中加入少量水,使NO2与水反应生成硝酸
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活息息相关,下列说法正确的是
A. 厨房用品中食醋和纯碱都属于弱电解质 B. 淀粉是天然高分子,淀粉溶液属于胶体
C. 空气是由几种单质构成的混合物 D. 石油的分馏、煤的干馏都属于物理变化
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂。有关资料为:
①CuCl为微溶于水的白色固体,在空气中可被迅速氧化
②CuOH为难溶于水的黄色固体,易分解为红色的Cu2O
③Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化为蓝色
I. 甲小组同学用如下装置电解食盐水,并对电解产物进行研究。
实验装置 | 电解质溶液 | 实验现象 | |
| 5mol/L NaCl溶液 | a极附近 | b极附近 |
开始时,产生白色浑浊并逐渐增加,当沉入U型管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
(1)若a极附近生成的白色浑浊是CuCl,则铜丝a应与电源的________极相连,铜丝a的电极反应式是____。
(2)b极附近溶液的pH_________(填“增大”、“减小”或“不变”)。
(3)橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是_____________(用方程式表示)。
(4)a极附近沉淀自下而上变为橙黄色原因是____________。
II. 乙小组同学通过以下方案制取CuCl并对其组成进行研究。
将Na2SO3的水溶液逐滴加入CuCl2的水溶液中,再加入少量浓盐酸调节到pH=3左右,即可得到白色沉淀CuCl。
(1)写出产生CuCl的离子方程式______________。
(2)为了提高CuCl的产率,可采用________法快速过滤,生产过程中调节溶液的pH不能过大的原因是___。
(3)为探究白色沉淀的化学组成,将制得的白色沉淀溶于浓氨水,得到无色溶液,将无色溶液分成两份,一份放置于空气中,一段时间后溶液变为蓝色;另一份的实验方法及现象为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com