
科目: 来源: 题型:
【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.00 g样品溶于水,配成250 mL溶液;
②用碱式滴定管准确量取25.00 mL所配溶液于锥形瓶中,滴加2~3滴酚酞溶液;
③用0.10 mol/L的标准盐酸滴定并重复三次,每次实验数据记录如下
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准溶液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)排去碱式滴定管中气泡的方法应采用下图中的操作 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
![]()

![]()
甲 乙 丙
(2)滴定过程中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点。
(3)判断滴定终点到达时的现象为 。
(4)若出现下列情况,测定结果偏高的是 。÷
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失
(5)通过计算可知该烧碱样品的纯度为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH: ①>②>④>③
C.①、④两溶液等体积混合,所得c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4, 则Va : Vb= 11 : 9
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产硝酸铜溶液的流程如下:
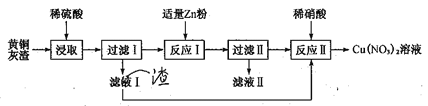
(1)写出酸浸时Fe2O3和稀硫酸反应的离子方程式:_________________。
(2)反应I中所加Zn不能过量的原因是________________。
(3)滤液II中含有的金属阳离子主要有_____________。
(4)写出反应II的离子方程式:______________。反应II应控制温度不能过高也不能过低的原因是___________________。
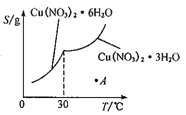
(5)已知Cu(NO3)2·6H2O和Cu(NO3)2·3H2O的溶解度随温度的变化如图所示。则由A点对应的溶液获取Cu(NO3)2·3H2O的方法是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物在人们的日常生活、工农业生产及科学研究中有着重要的作用。回答下列有关问题:
(1)煤炭是人们利用最为广泛的燃料,但因煤炭含硫而导致大气污染。对燃煤烟气中的SO2可采用碳酸钙浆液法吸收,即把燃煤烟气和空气同时鼓入到含CaCO3的浆液中,使SO2被吸收。①该反应生成石膏(CaSO4 2H2O),化学方程式为____________________。
②标准状况下,某种烟气中SO2含量为2.1×10-3g L-1,则反应中转移3 mol电子时,处理标
准状况下烟气的体积为___________L(保留两位有效数字)。
(2)工业炼铁的基本原理是:在高温下,焦炭燃烧生成的CO将铁矿石中铁的氧化物还原得到铁。
已知:
①Fe2O3(s)+3C(s,石墨)==2Fe(s)+3CO(g) △H= +489.0 kJ mol-1;
②C(s,石墨)+CO2(g) ==2CO(g) △H= +172.5 kJ mol-1。
则CO还原Fe2O3(s)的热化学方程式为_______________________。
(3)碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料。一定温度时,在容积为1.0 L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-3催化剂,容器中发生反应:2CH3OH(g) +CO2(g) ![]() CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:

已知:TON=![]()
①该温度时,甲醇的最高转化率为_______________。
② 0 ~7 h内DMC的平均反应速率是_______mol·L-1·h-1(保留两位有效数字)。
③图2是甲醇转化数随某种物理量的变化曲线,该物理量可能是_______;为使该反应向正
反应方向移动,可采取的措施有______________________。(答出一条即可)。
(4)CO2溶解于水形成碳酸。碳酸与次氯酸的电离常数如下表所示:
弱酸 | 碳酸 | 次氯酸 |
电离常数(Ka) | Ka1=4.4×l0-7 Ka2=5.6×10-11 | 3.0×10-8 |
在NaClO溶液中通入少量CO2 ,反应的离子方程式为_____________________,0.03 mol L-1 NaClO 溶液的 pH=________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体a mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器中仍剩有铜粉m2g,则(m1-m2)为
A. ![]() B.
B. ![]() C.0 D.缺少条件,无法计算
C.0 D.缺少条件,无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】现有温度相同、pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混合后,所得溶液的pH接近于
A.a-lg2 B.b-lg2 C.a+lg2 D.b+lg2
查看答案和解析>>
科目: 来源: 题型:
【题目】海水酸化将改变海水化学的种种平衡,使依赖于化学环境稳定性的多种海洋生物乃至生态系统面临巨大威胁。用生石灰中和法阻止海水酸化是人们的一种设想。生石灰属于( )
A.酸 B.碱 C.盐 D.氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.铜、石墨均导电,所以它们均是电解质
B.NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质
C.液态HC1、固体NaCl均不导电,所以HC1、NaCl均是非电解质
D.蔗糖、酒精在水溶液或熔融状态下均不导电,所以它们均是非电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为_________ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。

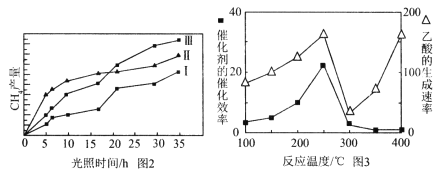
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com