
科目: 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变能使反应速率加快的是
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变能使反应速率加快的是
①增加铁的量
②将容器的体积缩小一半
③保持体积不变,充入N2 使体系压强增大
④保持体积不变,充入水蒸汽使体系压强增大
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是
A.1molN2(g)和1molO2(g)完全反应放出的能量为180kJ
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目: 来源: 题型:
【题目】关于反应CaCO3(s) = CaO (s)+CO2(g),下列说法中正确的是( )
A.△H < 0 B.△S < 0 C.高温下自发进行 D.一定不能自发进行
查看答案和解析>>
科目: 来源: 题型:
【题目】继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠——空气电池”。其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+。电池放电时,下列说法不正确的是

A. a电极为负极 B. Na+向b极移动
C. a极发生氧化反应 D. b电极的电极反应式:O2+2Na++4e- =Na2O2
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g) +O2(g)![]() SO3(g)是制备硫酸的重要反应,下列叙述中正确的是
SO3(g)是制备硫酸的重要反应,下列叙述中正确的是
A. 催化剂V2O5不改变该反应的逆反应速率
B. 不论以何种方式使反应体系的压强增大,化学反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应到达平衡的时间
D. 当该反应到达平衡时,SO2、O2、SO3都存在于反应体系中
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.40 |
下列有关叙述正确的是
A. 1000℃时,反应 1/2CO(g)+1/2H2O(g)![]() 1/2CO2(g)+1/2H2(g)的平衡常数为0.3
1/2CO2(g)+1/2H2(g)的平衡常数为0.3
B. 上述反应的正反应是吸热反应
C. 若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.5mol时,该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() =
=![]() ,则此时的温度为1200℃
,则此时的温度为1200℃
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为____________。
(2)CO2的电子式为____________,1 mol CO2分子中含有σ键的物质的量为____________。
(3)6-氨基青霉烷酸的结构如图所示:
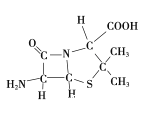
①其中C、N、O原子半径的大小关系为____________,电负性的大小关系为____________;
②其中采用sp3杂化的原子有C、____________。
(4)硝酸钾中NO3-的空间构型为____________,写出与NO3-互为等电子体的一种由前二周期元素原子构成的非极性分子化学式____________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是____________。
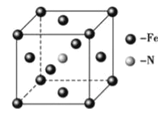
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为____________g/cm3(用NA表示阿伏加德罗常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com