
科目: 来源: 题型:
【题目】乙酸乙酯是非常重要的有机溶剂和化工原料,下图转化关系中的①、②、③是工业上合成乙酸乙酯的常见反应,其中A是一种常见的调味品。请回答:
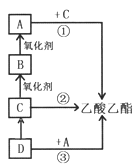
(1)有机物A中含有的官能团名称是____________。
(2)写出反应①的化学方程式_____________。
(3)已知反应②在催化剂作用下无需加入其他反应物即可一步合成产物,同时生成一种无色无味气体,该气体的化学式为_________。
(4)下列说法正确的是_________
A.将D通入溴水中,溴水褪为无色,原因是D与Br2发生了取代反应
B.C![]() B、B
B、B![]() A的氧化剂可以相同,也可以不同
A的氧化剂可以相同,也可以不同
C.反应③是①、②、③中唯一符合绿色化学的“零排放”要求的
D.已知量分子B可以通过一步反应生成乙酸乙酯,则同时有水生成
查看答案和解析>>
科目: 来源: 题型:
【题目】(13分)制取氨气并完成喷泉实验(图中夹持装置均已略去)。

(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验利用了氨气的 性质。
(4)如果只提供如图2的装置,请说明引发喷泉的方法 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A. 氯气溶于水:Cl2+H2O![]() 2H++ClO-+Cl-
2H++ClO-+Cl-
B. 亚硫酸钠溶液被空气中的氧气氧化:SO32-+O2=SO42-
C. 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D. 碳酸氢铵溶液和足量的氢氧化钠溶液混合加热:NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含NH3为1.7mg/L的废水3.00×105 L(密度为1g/cm3),第一步是微生物在O2充足的条件下,将NH3氧化为HNO3;第二步是加入甲醇(CH3OH,其中C的化合价为-2),还原HNO3,此反应化学方程式为:6NO3- + 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
请完成下列填空:
(1)写出第一步反应的化学方程式,并标出电子转移方向和数目:______________。
(2)氨气分子的空间形状是___________________________________;
(3)将Cu投入足量浓HNO3中,产生的现象是____________________、_____________________、
________________________________。
(4)上述在第二步反应中,氧化产物的电子式为________________。若反应中得到17.92L标况下的气体,该反应中转移电子数为_____________________________。
(5)处理上述废水,至少需要甲醇的质量是_____________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】“三酸两碱”是最重要的无机化工产品,广泛用于化学、国防、石油、纺织、冶金、食品等工业。“三酸”是指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。回答下列问题:
(1)浓硝酸不稳定,易分解,需要保存在_____________色细口瓶,并用________塞盖好,该分解的方程式为_______________________。
(2)将红热的木炭,投入热的浓硝酸中,看到的现象是______________________。写出该反应的化学方程式______________________________。
(3)等物质的量的氯气与二氧化硫通入水中,溶液中存在的主要离子为_______________,往反应后溶液中滴入紫色石蕊试液,现象是_______________________________,往反应后溶液中BaCl2溶液后的离子方程式为__________________________________。
(4)写出氨水与稀盐酸反应的离子方程式___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
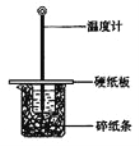
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热△H_____ (填“相等、不相等”)
(4)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求的中和热△H会 (填“偏大”、“偏小”、“无影响”) 若用KOH代替NaOH,实验所测的热量会_________________(填“偏大”、“偏小”、“无影响”)。
(5)他们记录的实验数据如下:
实验用品[ | 溶液温度 | 中和热 △H | |||
起始平 均温度 | 反应最高温度 | ||||
① | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均视为1g·cm-3。
①根据上表数据计算中和热△H=__________(保留至小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)_______________。
A.实验装置保温、隔热效果差
B.量取稀盐酸溶液的体积时仰视读数
C.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】国内外医学界最新研究表明,如果人体不缺乏微量元素而随意过量补充的话,不仅对健康无益反而有害,下列元素属于微量元素的是( )
A. Fe B. Ca
C. H D. K
查看答案和解析>>
科目: 来源: 题型:
【题目】医生给病人开处方时都会告诉病人服药时要饭前或饭后半小时服用,不要空腹吃药。这是为什么呢?对此解释正确的是( )
A. 空腹吃药不利于药的消化和吸收
B. 空腹吃药会影响药的药效
C. 空腹吃药会使病人产生药物过敏
D. 空腹吃药会损伤胃壁,出现胃溃疡等疾病
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com