
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
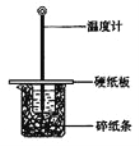
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热△H_____ (填“相等、不相等”)
(4)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求的中和热△H会 (填“偏大”、“偏小”、“无影响”) 若用KOH代替NaOH,实验所测的热量会_________________(填“偏大”、“偏小”、“无影响”)。
(5)他们记录的实验数据如下:
实验用品[ | 溶液温度 | 中和热 △H | |||
起始平 均温度 | 反应最高温度 | ||||
① | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均视为1g·cm-3。
①根据上表数据计算中和热△H=__________(保留至小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)_______________。
A.实验装置保温、隔热效果差
B.量取稀盐酸溶液的体积时仰视读数
C.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
【答案】(1)环形玻璃搅拌棒
(2)偏小
(3)不相等;相等
(4)偏大; 无影响;
(5)①△H=-56.8kJ/mol;②HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq)△H=-56.8kJ/mol(可写成离子方程式)
(6)AD
【解析】试题分析:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸进行上述实验,测得中和热数值相等;故答案为:不相等;相等;
(4)氨水属于弱碱,电离是需要吸收热量,如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,放出的热量偏少,所求的中和热△H会偏大;KOH属于强电解质,若用KOH代替NaOH,实验所测的热量不变,故答案为:偏大; 无影响;
(5)①2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值=3.4℃,50mL0.55molL-1NaOH和50mL.0.5molL-1HCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为![]() =56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,故答案为:△H=-56.8kJ/mol;
=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,故答案为:△H=-56.8kJ/mol;
②NaOH溶液与HCl溶液反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l) △H=-56.8kJ/mol,故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol;
(6)A.实验装置保温、隔热效果差,热量散失较大,所得中和热的数值偏小,故A正确;B.量取稀盐酸溶液的体积时仰视读数,会导致所量的稀盐酸体积偏大,放出的热量偏高,则大于57.3kJ/mol,故B错误;C.一次性把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较少,所得中和热的数值偏大,故C错误;D.温度计测定NaOH溶液起始温度后直接插入稀HCl测温度,盐酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故D正确;故答案为:AD。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 )____min,原因是_________________。
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率________________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列__________以减慢反应速率。(填写代号)
A.蒸馏水 B.冰块 C.HNO3溶液 D.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图。

①该反应的化学方程式是________。
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率=(转化的物质的量/初始物质的量)×100%】,请写出计算过程,计算结果保留1位小数)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密度为0.910 g·cm-3的氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SO2、CO2、SiO2中的S、C、Si均为sp3杂化
B.H3O+、NH4+、[Cu(NH3)4]2+均含有配位键
C.SO32—、CO32—、SiO32—均为平面三角形
D.石墨、新型高分子导电材料、聚乙烯、金属晶体均含有金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是非常重要的有机溶剂和化工原料,下图转化关系中的①、②、③是工业上合成乙酸乙酯的常见反应,其中A是一种常见的调味品。请回答:
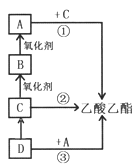
(1)有机物A中含有的官能团名称是____________。
(2)写出反应①的化学方程式_____________。
(3)已知反应②在催化剂作用下无需加入其他反应物即可一步合成产物,同时生成一种无色无味气体,该气体的化学式为_________。
(4)下列说法正确的是_________
A.将D通入溴水中,溴水褪为无色,原因是D与Br2发生了取代反应
B.C![]() B、B
B、B![]() A的氧化剂可以相同,也可以不同
A的氧化剂可以相同,也可以不同
C.反应③是①、②、③中唯一符合绿色化学的“零排放”要求的
D.已知量分子B可以通过一步反应生成乙酸乙酯,则同时有水生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是( )。
A. 溶液的pH增大 B. 溶液中的Zn2+浓度增大
C. 溶液中的SO![]() 浓度增大 D. 溶液的密度增大
浓度增大 D. 溶液的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、氮氧化物等,科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0KJ/mol
2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4KJ/mol
N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
请判断反应NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH4,在低温下能否自发进行,并说明理由______________________。
(2)已知TiO2催化尾气降解原理为:2CO(g)+O2(g) ![]() 2CO2(g); 2H2O(g)+4NO(g)+O2(g)
2CO2(g); 2H2O(g)+4NO(g)+O2(g) ![]() 4HNO3(g)。
4HNO3(g)。
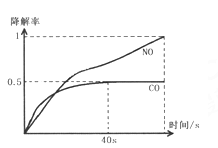
Ⅰ.在O2浓度几乎不变的条件下,模拟CO、NO的降解,得到降解率随时间变化如图1所示(![]() ),反应40秒后检测HNO3气体浓度有所降低,请用化学方程式结合化学反应原理知识解释出现该现象可能的原因_______________________。
),反应40秒后检测HNO3气体浓度有所降低,请用化学方程式结合化学反应原理知识解释出现该现象可能的原因_______________________。
Ⅱ.图2为在不同颗粒间隙的沥青混凝土(α、β型)和不同温度下,实验进行相同一段时间(t秒)后测得的CO降解率变化,回答谢列问题:
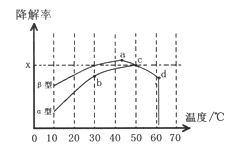
①已知50℃、t秒时容器中O2浓度为0.01mol/L,求此温度下CO降解反应的平衡常数_______。
②下列关于图2的叙述不正确的是_________
A.根据降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.a点的数据反映出CO与O2之间所发生的有效碰撞频率是整个实验过程中最高的
D.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10-60℃范围内进行实验,请在图2中用线段与阴影仿照“示例”描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(示例:![]() )。________________________
)。________________________
(3)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人口资源环境委员会副主任、中国科学院院士秦大河表示,当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因。煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一。
⑴已知:H2O(g)=H2O(I) △H=-44kJ/mol
物质 | H2(g) | C(s) | CO(g) |
燃烧热kJ/mol | -285.8 | -393.5 | -283.0 |
①请写出煤的气化反应生成合成气(CO和H2)的热化学方程式___________。
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是_______。
a.混合气体平均相对分子质量不再改变
b.气体压强不再改变
c.各气体浓度相等
d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍
f.混合气体密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
⑵在催化剂作用下合成气合成甲烷过程中会发生如下反应:
I CO(g)+3H2(g) = CH4(g)+H2O(g) △H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) △H2= -41 kJ/mol
Ⅲ 2CO(g)+2H2(g)= CH4(g)+CO2(g) △H 3= -247.4 kJ/mol
①图1是太原理工大学煤化工研究所利用热力学数据分析得到温度对反应ⅠInK(化学平衡常数K的自然对数)的曲线图,请分析出现这样趋势的原因是____________。

②提高甲烷反应选择性的关键因素是_______,根据相关知识和图2分析合成甲烷适宜的反应条件是
在550~630K,1MPa的原因是__________________。
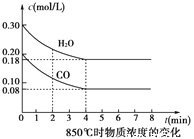
③850℃时在体积为5L反应器中发生反应Ⅱ,CO和H2O(g)浓度变化如图所示,请列式计算此条件下的平衡常数_____________ 。
(3)CH4燃料电池利用率很高,装置中添加1L2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷22.4L~33.6 L时负极电极反应为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com