
科目: 来源: 题型:
【题目】能证明氢氟酸是弱酸的实验事实是
A.HF溶液与Zn反应放出H2
B.0.1mol/LNaF溶液的pH大于7[
C.HF溶液与Na2CO3反应生成CO2
D.0.1mol/LHF溶液可使紫色石蕊变红
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应A+3B2C+D在某段时间内以A的浓度变化表示的化学反应速度为1molL﹣1min﹣1 , 则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5molL﹣1min﹣1
B.1molL﹣1min﹣1
C.2molL﹣1min﹣1
D.3molL﹣1min﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是

A.若b、c两点的平衡常数分别为K1、K2,则K1>K2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率可采取增加Br2(g)通入量的方法
D.b、c两点的HBr的体积分数b>c
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,1 molX和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)![]() 2Z(g)+M(s),5min后达到平衡,此时生成0.2 mol Z。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成0.2 mol Z。下列说法正确的是
A.若将容器压缩时,正逆反应速率均不变
B.5 min内平均反应速率v(X)=0.02 mol/(L·min)
C.向平衡后的体系中加入l molM(s),平衡向逆反应方向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图所示)可用于ⅢB族元素对应的离子萃取,如La2+、Sc2+。写出基态二价钪离子(Sc2+)核外电子排布式:__________。其中电子占据的轨道数为__________个。
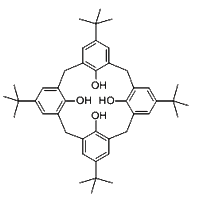
(2)对叔丁基杯[4]芳烃由4个烃基构成杯底,其中条件氧原子的杂化方式为___________。烃基间的相互作用力为_______________。
(3)不同大小的杯芳烃能识别某些离子,如:N3-、SCN-等。根据等电子体原料判断N3-空间构型为______;一定条件下,SCN-与MnO2反应可得到(SCN)2。试写出(SCN)2 的结构式:_______________。
(4)已知C60分子结构和C60晶胞示意图(如图Ⅱ,图Ⅲ所示):
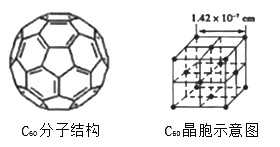
则一个C60分子中含有σ键个数为__________,与每个C60分子距离最近且相等的C60分子有_________个,C60晶体的密度为__________(计算结果保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+ + 6HCHO = 3H++ 6H2O + (CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:

若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮元素的质量分数为 。(结果保留四位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:

已知:CaO2·8H2O呈白色微溶于水。
(1)写出反应①中氧化还原反应的离子方程式: ______________。
(2)向反应①后的溶液中加浓氨水的目的是: __________________。
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①__________________;②______________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴滴入浓度为c mol·L-1的Na2S2O3标准溶液至反应终点,消耗Na2S2O3溶液V mL。
已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①滴定终点的现象为____________,产品中CaO2的质量分数为_________________
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________ (填“不受影响”“偏低”或“偏高”),原因是_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】
A是一种重要的化工原料,已知A是一种卤代烃,相对分子质量为92.5,其核磁共振氢谱中只有一个峰,C是一种高分子化合物,M是一种六元环状酯,转化关系如图所示,回答下列问题:
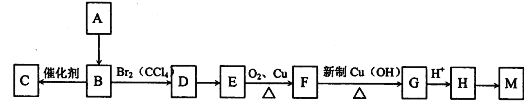
(1)A的分子式为_____;A→B的反应类型___;
(2)写出结构简式:D __,M的结构简式为___。
(3)写出下列反应的化学方程式:B→C:_____________;E→F_________________。
(4)满足下列条件的H的同分异构体共有__________种。写出其中一种同分异构体的结构简式______。
①属于酯类; ②能发生银镜反应; ③能与金属钠反应放出气体。
查看答案和解析>>
科目: 来源: 题型:
【题目】某KNO3溶液中含杂质KCl和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.AgNO3、K2CO3 B.AgNO3、K2CO3、HNO3
C.K2CO3、AgNO3 D.K2CO3、AgNO3、HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com