
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是_________,除⑩外原子半径最大的是________。
(2)①③⑤三种元素最高价氧化物对应的水化物碱性最强的是__________ ;⑧⑨形成氢化物的稳定性由强到弱顺序为_________________。
(3)①②③⑤⑧五种元素形成的离子半径由大到小的顺序为______________________
(4)元素⑥的名称是____;元素④的原子结构示意图是/span>_______;元素⑦的氢化物和元素①单质反应的化学方程式为________________。
(5)①⑨形成的化合物灼烧时火焰焰色为________;该化合物的溶液与元素⑧的单质反应的化学方程式为_______________________。
(6)①、⑤和⑧最高价氧化物对应的水化物之间两两相互反应的离子方程式为____________________。
(7)元素③的单质在元素⑥⑦形成的某化合物中燃烧的化学方程式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
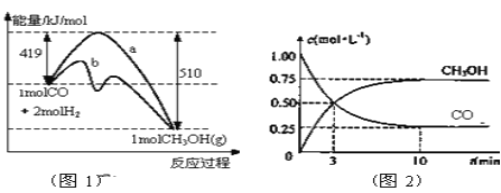
请回答下列问题
(1)在“图1”中,曲线______(填a或b)表示使用了催化剂;该反应属于_____________(填吸热、放热)反应。
(2)从反应开始到建立平衡, v(H2)=________;反应达到化学平衡时,下列有关叙述正确的是______ 。
a.容器内气体压强保持不变
b.反应放热182 kJ
c.若升温,该反应的v(正)增大,v(逆)减小
d.若向容器内通入少量氢气,则此时v(正)>v(逆)
(3)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH(l)+ 3O2(g)==2CO2(g)+4 H2O(l)。其工作原理示意图如下:
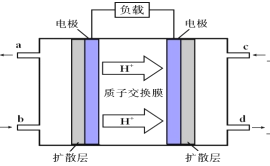
①上图的出入口通入或排出的物质名称(或化学式)b________ ,a_____________.
②负极的电极反应式为_____________________________________。电池中放电过程中负极附近溶液的pH将_____________(填“下降”、“上升”或“不变”);
(4)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷代表汽油。该电池的正极反应式___________________________。该电池的负极反应式__________________________________。放电时固体电解质里的O2-离子的移动方向是向_________________极移动(填“正”或“负”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下列有关两种溶液的说法不正确的是( )
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A. ①②两溶液中c(OH-)相等
B. ①溶液的物质的量浓度为0.01mol·L-1
C. ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D. 等体积的①②两溶液分别与0.01mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】已知将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应H2O2+2H++2I-═2H2O+I2,且生成I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成I2完全消耗.由于溶液中I-继续被H2O2氧化,生成I2与淀粉作用,溶液立即变蓝.因此,根据试剂X量、滴入双氧水至溶液变蓝所需时间,即可推算反应H2O2+2H++2I-═2H2O+I2反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
0.1mol·L-1 KI溶液 | H2O | 0.01mol·L-1 X溶液 | 0.1mol·L-1 双氧水 | 0.1mol·L-1 稀盐酸 | |||
1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-═2H2O+I2反应速率的影响。
实验2中m= ,n= 。
(2)一定温度下,H2O2+2H++2I-═2H2O+I2,反应速率可以表示为v=k·c a(H2O2)·c b (I-)·c(H+)(k为反应速率常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=__________min;
②根据上表数据可知,a、b的值依次为 和 。
(3)若要探究温度对H2O2+2H++2I-=2H2O+I2反应速率影响,在实验中温度不宜过高且采用水浴加热,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是
A. 将少量SO2气体通入Ba(OH)2溶液中,有白色沉淀生成
B. 将SO2气体通入BaCl2溶液中,有白色沉淀生成
C. 将SO2气体通入用硝酸酸化过的BaCl2溶液中,有白色沉淀生成
D. 将硝酸酸化的BaCl2溶液加入某溶液中有白色沉淀产生,不能判断该溶液中一定存在SO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法正确的是( )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO(g)
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
①在热化学方程式中无论是反应物还是生成物都必须标明状态 ②所有的化学反应都伴随着能量变化 ③放热反应发生时不必加热 ④吸热反应在加热后才能发生 ⑤化学反应的热效应数值只与参加反应的物质的多少有关 ⑥一般来说,吸热反应在一定条件下也能发生 ⑦依据盖斯定律,反应焓变的大小与反应的途径有关
A.②③⑥⑦ B.③④⑤⑦ C.④⑤⑦ D.③④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示:挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球影响,以及外界和广口瓶间热量的传递影响)。则所用试剂不可能是
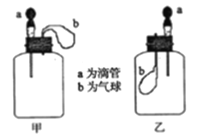
A. 甲:H2O和CaO(固体);乙:H2O和NH4NO3(固体)
B. 甲:盐酸和Na2O2(固体);乙:亚硫酸钠溶液和氯气
C. 甲:NaOH溶液和CO2;乙:盐酸和NaHCO3溶液
D. 甲:稀盐酸和大理石粉末(固体);乙:H2O和NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】胶体区别于其它分散系的本质是
A. 胶体的分散质粒子直径在1nm~100nm之间
B. 胶体粒子带电荷并且在一定条件下能稳定存在
C. 胶体粒子不能穿过半透膜,能通过滤纸空隙
D. 光束通过胶体时有丁达尔效应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH=-Q1;
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2;
H2O(g)=H2O(l) ΔH=-Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
A.4Q1+0.5Q2 B.4Q1+Q2+10Q3 C.4Q1+2Q2 D.4Q1+0.5Q2+9Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com