
科目: 来源: 题型:
【题目】将2molSO2和1molO2分别置于相同体积的甲乙两密闭容器中发生反应2SO2+O2(g)![]() 2SO3(g),并达到平衡。在这过程中,甲容器保持恒温恒容,乙容器保持恒温恒压,达到平衡时,下列说法正确的是( )
2SO3(g),并达到平衡。在这过程中,甲容器保持恒温恒容,乙容器保持恒温恒压,达到平衡时,下列说法正确的是( )
A.达到平衡所需的时间为:甲>乙 B.甲的转化率>乙的转化率
C.混合气体中SO3的含量为:甲>乙 D.气体的总物质的量:甲<乙
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 浓度均为0.1 molL﹣1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③<②<①
B. 工业上常用Na2SO3溶液作为吸收液脱除烟气中的SO2 ,随着SO2的吸收,吸收液的pH不断变化。当吸收液呈酸性时:c (Na+)=c (SO32﹣)+c (HSO3﹣)+c (H2SO3)
C. 常温下,将0.1 molL﹣1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CH3COO-)/c(CH3COOH)的值增大到原来的100倍
D. 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:
NiO(OH)+H2O+e-=Ni(OH)2+OH-
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】铜的硫化物可用于冶炼金属铜。为测定某试样中Cu2S、CuS的质量分数,进
行如下实验:
步骤1:在0.7500g试样中加入100.00mL0.1200mol/L KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用0.1000mol/L FeSO4溶液滴定至终点,消耗16.00mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1gKI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-=2CuI↓+I2。用0.05000mol/L Na2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2![]() 2I-+S4O62-),消耗14.00mL。
2I-+S4O62-),消耗14.00mL。
(1)写出Cu2S与KMnO4酸性溶液反应的化学方程式________________
(2)步骤3中加入氨水的目的为__________________;如果未加入氨水,则测得的Cu2+的物质的量将__________(填“偏高”“偏低”或“不变”),混合固体中CuS的质量分数将__________(填“偏高”“偏低”或“不变”)
(3)当加入氨水使得溶液pH=2.0时,则溶液中c(Fe3+)=____________,
(4)根据题中数据,计算混合固体中Cu2S的质量分数w(Cu2S)=______CuS的质量分数w(CuS)=_______
查看答案和解析>>
科目: 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol﹣1
2C(s)+O2(g)=2CO(g) △H=﹣221.0kJmol﹣1
C(s)+O2(g)=CO2(g) △H=﹣393. 5kJmol﹣1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_____ kJmol﹣1,利于
该反应自发进行的条件是_______(选填“高温”或“低温”)。

(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:
2NO(g)+2CO(g)N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图所示:
反应从开始到9min时,用CO2表示该反应的速率是____________________(保留2位有效数字)
②第12min时改变的条件是______________(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为______________(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”)。
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是________________(填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
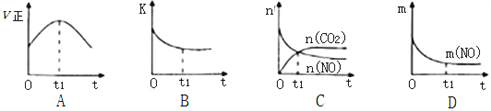
(4)以氨为燃料可以设计制造氨燃料电池,产物无污染。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】环境污染已严重危害人类的生活。下列对应关系正确的是
选项 | 环境问题 | 造成环境问题的主要物质 |
A | 酸雨 | O3 |
B | 温室效应 | CO2 |
C | 南极臭氧层空洞 | SO3 |
D | 光化学烟雾 | N2 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于铜电极的叙述中不正确的是
A.锌、铜电极和稀硫酸溶液构成的原电池中铜是正极
B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼粗铜时粗铜发生氧化反应
D.用电解法精炼粗铜时纯铜作阳极
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验操作或现象与实验结论都正确的是
选项 | 实验操作或现象 | 实验结论 |
A. | 铜和浓硝酸反应制备NO2;二氧化锰与浓盐酸反应制备Cl2 | 均有电子转移 |
B. | 向沸水中滴加氯化铁溶液制氢氧化铁胶体;蛋白质在酶的作用下生成氨基酸 | 水均作氧化剂 |
C. | SO2使品红溶液褪色;乙烯使溴水褪色 | SO2与乙烯 均表现漂白性 |
D. | 用pH试纸测定纯碱溶液的pH;用淀粉KI试纸检验O3 | 试纸均需湿润 |
查看答案和解析>>
科目: 来源: 题型:
【题目】[2016海南]下列有关实验操作的叙述错误的是
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com