
科目: 来源: 题型:
【题目】下列说法正确的是
A. 无水CaCl2可用于干燥H2、Cl2和NH3
B. 无水硫酸铜与胆矾的相互转化属于化学变化
C. 代替传统火药鞭炮的“电子鞭炮”无任何的污染问题
D. 制造光导纤维的主要材料为晶体硅
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸的下列性质中,可以证明它是弱电解质的是( )
A. 1mol/L甲酸溶液的c(H+)=10-2mol/L; B. 甲酸以任何比与水互溶;
C. 10mL1mol/L甲酸恰好与10mL1mol/LNaOH溶液完全反应; D. 甲酸溶液的导电性比盐酸溶液弱;
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.在常温常压下,1mol氦气含有的原子数为NA
B.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
C.标准状况下,32gSO2的体积约为22.4L
D.物质的量浓度为1molL﹣1的K2SO4溶液中,含2NA个K+
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件己略去)。A是常见的金属单质, B是常见的强酸,D是常见的气体单质,E是空气中含量最多的气体,I是既能与强酸又能与强碱反应的氧化物,G是最常见的无色液体,J是一种高硬度材料(摩尔质量为41g/ mol)。

请回答下列问题:
(1)D的化学式为___________。
(2)F的电子式为___________。
(3)G的结构式为___________。
(4)写出反应①的离子方程式:___________。
(5)写出反应②的化学方程式:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,在0.2 mol·L-1Al2(SO4)3,溶液中,逐滴加入1.0mol·L-1NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-![]() Al(OH)3
Al(OH)3
B.a~b段,溶液pH增大,A13+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②需要加热才能发生的反应都是吸热反应
③热化学方程式应注明反应时的温度与压强,若没注明则表示常温、常压时的反应
④等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑤H2(g)+I2(g)![]() 2HI(g) ΔH=-QkJ·mol-1,表示常温,常压下,在恒温密闭容器中当有1molH2和1mol I2(g)反应,生成2molHI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1,表示常温,常压下,在恒温密闭容器中当有1molH2和1mol I2(g)反应,生成2molHI时放出QkJ的热量
⑥同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照条件下和点燃条件下的ΔH相同
A. 1项 B. 2项 C. 3项 D. 5项
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂用一固体废渣(主要成份为Al2O3·Cr2O3,还含有FeO、SiO2)为主要原料回收利用,生产红矾钠晶体(Na2Cr2O7·2H2O),同时制备明矾(KAl(SO4)2·12H2O)。其主要工艺流程如下:
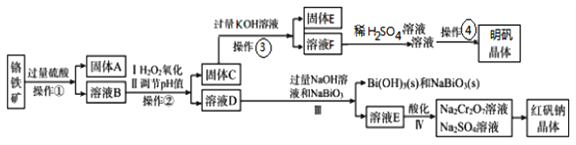
己知:NaBiO3不溶于冷水,在碱性条件下能将Cr3+氧化为CrO42-
(1)I、II目的是___________。
(2)实验室中操作④的名称为_______________。
(3)己知:Ksp[Fe(OH)3]=3.0×10-39,Ksp[Al(OH)3]=3×10-33。当pH=5.6时Cr(OH)3开始沉淀。室温下,II中需调节溶液pH范围为___________(杂质离子浓度小于1×10-6mol/L视为沉淀完全)。
(4)写出Ⅲ中发生反应的离子方程式_____________。
(5)IV中酸化是用硫酸而不用盐酸酸化,理由是_____________(结合化学方程式回答)。
(6)写出溶液F和硫酸溶液反应的离子方程式_________,若用足量二氧化碳通入F中,则生成的溶液中离子浓度关系为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中逐渐加入0.2 mol·L-1 CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
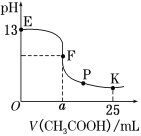
A.a=12.5,且混合溶液pH=7
B.对应曲线上E、F之间的任何一点,溶液中都有 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且毎个能级所含的电子数相间;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出:D基态原子的价层电子排布图__________;F基态原子的外围电子排布式:_________。
(2)下列说法错误的是_________。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似。
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F硫酸盐溶液中通入过量的C与A形成的气体X可生成[F (X)4]2+,该离子的结构式为______(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有________。
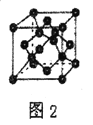
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为_______。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm, F离子的半径b pm,求该晶胞的空间利用率________。

查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是

A.在任何溶液中,若有 CaSO4沉淀析出,则c(Ca2+) 与c(SO42-)一定相等
B.d点溶液通过蒸发可以变到c点
C.a点对应的Ksp等于c点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol·L -1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com