
科目: 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)的分解反应。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15 | 20 | 25 | 30 | 35 |
平衡总压强/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①该可逆反应的平衡常数的表达式为________________________
②可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中CO2的体积分数不变
D.密闭容器中总压强不变
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25 ℃下达到分解平衡。若在恒温下增大容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
④该反应的焓变ΔH_________0(填“>”、“=”或“<”)
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g) ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】化学是以实验为基础的自然科学,下列实验操作方法正确的是()
A. 酒精灯在桌子上歪倒着火,立即用水浇灭
B. 给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人
C. 使用pH试纸测量溶液的酸碱性时,先把pH试纸用蒸馏水润湿后,再测量
D. 将润湿的红色石蕊试纸置于集气瓶内部,试纸变蓝说明氨气已收集满
查看答案和解析>>
科目: 来源: 题型:
【题目】过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是 ( )
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
查看答案和解析>>
科目: 来源: 题型:
【题目】部分弱酸的电离平衡常数如表。
弱酸 | HCOOH | H2S | H2SO3 |
电离平衡常数 (25℃) | K=1.8×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 |
(1)物质的量均为0.1mol/L的溶液①HCOONa②NaHS③Na2SO3,pH最大的是________(填编号)
(2)设计实验证明HCOOH为弱酸
(3)室温下,下列溶液中水电离出的c(H+)水由大到小的顺序为________(填编号)
①pH=12的NaOH溶液 ②NaCl溶液 ③pH=6的NH4Cl溶液 ④0.01mol/L醋酸
(4)二元酸H2A在水中存在以下电离:H2A=H++HA-,HA-![]() H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性” )
②某温度下,10mL、0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至中性,此时溶液中以下关系一定正确的是( )
A.溶液的pH=7 B.Kw=c2(OH-) C.V=10 D.c(K+)< c(Na+)
(5)如图横坐标为室温下溶液的pH,纵坐标为金属离子物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答:
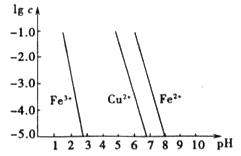
腐蚀铜板的溶液中,若Cu2+、Fe3+、Fe2+浓度均为0.1mol/L,向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。
从图中的数据计算可得Fe(OH)2溶度积Ksp[Fe(OH)2]= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下列是一些化学键的键能,根据键能数据估算反应CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H为:( )
化学键 | C﹣H | C﹣F | H﹣F | F﹣F |
键能/(kJmol﹣1) | 414 | 489 | 565 | 155 |
A. +485 kJmol﹣1 B. ﹣485 kJmol﹣1
C. +1940 kJmol﹣1 D. ﹣1940 kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题。
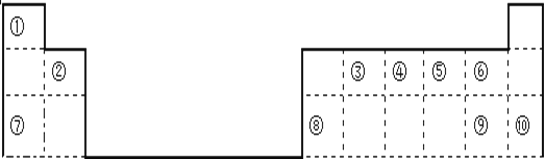
(1)⑨在周期表中的位置是__________________________;
(2)⑥对应的气态氢化物沸点高于同主族元素对应的气态氢化物,原因是______________;
(3)①⑤两元素可以形成原子个数比1︰1和2︰1的化合物X和Y,其中X的电子式为__________,用电子式表示Y的形成过程______________________________________;
(4)实验室制取④的最简单氢化物的化学反应方程式是:______________________________;
(5)由①③⑤三种元素组成的化合物之一Z,是生活中常见的有机化合物,它具有特殊的香味,写出Z发生催化氧化的反应方程式:_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁碳合金在现代建筑中占有十分重要的地位。
(1)基态Fe3+的M能层上电子排布式为_______,铁元素可形成多种配合物,如K3[Fe(CN)6]和Fe(CO)5,则这两种配合物所涉及的元素中,第一电离能由大到小的顺序为________,电负性最大的是_______。
(2)三聚氰胺(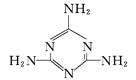 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
①三聚氰胺中,环上与环外的氮原子杂化轨道类型分别为_______。
②导致三聚氰胺与硝基苯熔点相差很大的根本原因是____________________。
(3)已知常温下草酸(HOOC—COOH)的电离平衡常数Ka1=5.6×10-2、Ka2=1.5×10-4,试从结构上解释Ka1、Ka2数值上的差异__________________。
(4)一定条件下,碳、氮两种元素可形成一种化合物,该化合物可作耐磨材料,其熔点________(填“高于”、“低于”或“无法判断”)金刚石的熔点。
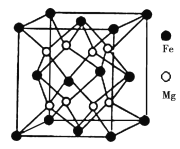
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____________(不必化简,用NA表示阿伏加德罗常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com