
科目: 来源: 题型:
【题目】尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g) ![]() 2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________;NO和NO2以物质的量之比1:1与
CO(NH2)2反应生成无毒气体的化学方程式为_________________________。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H__________(填“>”或“<”)0;348K时,该反应的平衡常数K__________________。
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图
所示。
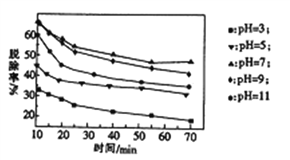
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________。
②脱硝时,最佳pH为_________;在碱性较强时,NOx脱除率降低,其原因是_____________________
(任写一点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】1 mol某链烃最多能和2 mol HCl发生加成反应,生成1 mol 氯代烷,1 mol该氯代烷能和6 mol Cl2发生取代反应,生成只含碳元素和氯元素的氯代烃,该烃可能是
A.CH3CH=CH2B.CH3C≡CH
C.CH3CH2C≡CHD.CH2=CHCH=CH2
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法,完成下列问题:

(1)方法一:H2S热分解法,反应式为:H2S (g) ![]() H2 (g)+S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为c mol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
H2 (g)+S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为c mol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
①△H___________0(填“>”“<”或“=”)。
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:_________________。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I.C(s) + H2O (g) = CO (g) + H2(g) △H = + 131.6 kJ/mol
II.CO (g) + H2O (g) = CO2 (g) + H2 (g) △H = -43 kJ/mol
III.CaO(s) + CO2(g) = CaCO3(s) △H = -178.3 kJ/mol
①计算反应C (s) +2H2O(g) +CaO(s) ==CaCO3 (s)+2H2 (g)的△H=_____(保留到小数点后面1位);若K1、K2、K3分别为反应I、II、III的平衡常数,该反应的平衡常数k=______(用K1、K2、K3表示)。
②对于可逆反应C (s) +2H2O(g) +CaO(s) ![]() CaCO3 (s)+2H2 (g),采取以下措施可以提高H2产率的是___。 (填字母编号)
CaCO3 (s)+2H2 (g),采取以下措施可以提高H2产率的是___。 (填字母编号)
A.适当的降低体系的温度 B.使各气体组分浓度均加倍
C.用特殊材料吸收氢气 D.增加CaO的量
③图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c( H2O)=2c(H2)= 2c(CO)=2 mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。___________________
(3)以N2、H2为电极反应物,以HCl-NH4C1为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(2016天津)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。
已知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)从以下所给物质中选出甲同学设计的实验所用到物质:图1中试剂A、B为(填序号)____;
①稀硫酸溶液; ②浓盐酸; ③碳酸钠粉末;④Na2SO3溶液
写出图1烧瓶中发生反应的离子方程式为__________________________________________;
(2)甲同学所做实验图1烧杯中现象为____________________________________;
(3)乙同学所做实验图2中B处的现象为__________________________________;
(4)写出图2中A处发生反应的离子方程式为__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B. 对2H2O2![]() 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C. 反应CO+NO2![]() CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D. 合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
查看答案和解析>>
科目: 来源: 题型:
【题目】表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
A | B | ||||||
D | E | F | |||||
C | G | H |
(1)上述元素的单质中熔点最高的可能是________________(填名称)。
(2)D的氢化物比G的氢化物稳定,其原因是__________________________________________________________。
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为___________;该物质溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(4)现有另一种元素X,其原子获得一个电子所释放出的能量是上表中所列元素中最大的,则X是周期表中第__________族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的___________(填字母代号)元素组成的,用化学方程式表示吸收原理_________________________________________________________________。
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O
B.稀盐酸与氢氧化钡溶液反应:H++OH-=H2O
C.硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+==BaSO4↓
D.稀硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com