
科目: 来源: 题型:
【题目】下列关于氧化物的叙述正确的是
A. 金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B. 酸性氧化物都能与水化合生成酸
C. 碱性氧化物都能与水化合生成碱
D. 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】120℃时1体积某气态烃和4体积O2混合,完全燃烧后恢复到原来的温度和压强时,体积不变,该分子式中所含的碳原子数不可能是
A. 1 B. 2 C. 3 D. 7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或做法不正确的是
A. 用核磁共振氢谱不能鉴别二甲醚和乙醇
B. 红外光谱法可获得有机分子中含有何种化学键或官能团的信息
C. 甲烷分子是正四面体结构,则二氯甲烷不存在同分异构体
D. 质谱法可快速、微量、精确测定相对分子质量
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿佛加德罗常数的值,下列说法正确的是( )
A. 标准状况下,将6.72L的NO2通入足量的水中转移电子数为0.3NA
B. 常温常压下,22.4LCCl4含有NA个CCl4分子
C. 1 mol Na与足量O2反应,生成Na2O和Na2O2混合物,转移的电子数为NA
D. 18 g D2O所含的电子数为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】(1) ![]() 用系统命名法命名:________________;
用系统命名法命名:________________;
(2)下列实验操作或对实验事实的描述中正确的说法有____________________;
① 分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
② 除去甲烷中混有的少量乙烯,可以让混合物通过盛有酸性KMnO4溶液的洗气装置
③ 苯与溴水制溴苯
④ 只用溴水就可将苯、四氯化碳、乙醇、己烯四种液体区别开来
⑤ 用分液法分离苯和硝基苯的混合物
⑥酯类在碱性条件下的水解反应叫皂化反应
⑦裂化的目的主要是制得更多的乙烯、丙烯等不饱和烃
⑧除去乙酸乙酯中的乙酸也可以用氢氧化钠溶液洗涤,然后再分液
⑨煤中含有苯、甲苯,可先干馏后分馏的方法把它们分离出来
⑩乙烷、苯、乙醇、乙酸、乙酸乙酯均可发生取代反应
(3)某芳香烃结构为![]() ,它的分子式为_____,它的一氯代物有____种。
,它的分子式为_____,它的一氯代物有____种。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:

已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。
查看答案和解析>>
科目: 来源: 题型:
【题目】溴化铜(II)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
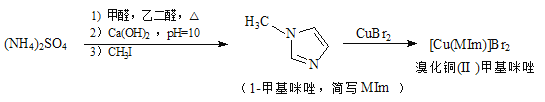
(1)铜元素位于周期表中第_____族,写出基态Cu2+的电子排布式_______。
(2)与NH4+互为等电子体的阴离子为_______。
(3)SO42-中心原子的杂化方式为_________。
(4)Mlm中含σ键与π数目之比为__________。
(5)一种铜的溴化物晶胞结构如下图所示。
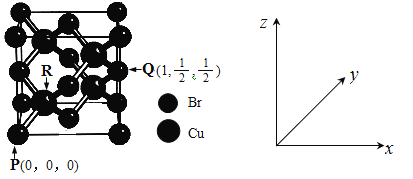
由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为______。

(6)Cu晶体的堆积方式如图所示,设Cu原子半径为a,晶体中Cu原子的配位数为____,晶体的空间利用率为__________。(列式计算)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A. 氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
B. 已知2C(石墨,s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C. 已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2 和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2 和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量
D. 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ·mol-1和1 411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为C2H4(g)+H2O(l)===C2H5OH(l) ΔH=-44.2 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,CH3COOH:K=1.75×10-5,H2S:K1=1.3×10-7、K2=7.1×10-15。物质的量浓度均为0.1 mol/L的①CH3COONa溶液 ②Na2S溶液 ③NaHS溶液,三种溶液的pH由小到大的顺序是
A. ①③② B. ③①②
C. ③②① D. ②①③
查看答案和解析>>
科目: 来源: 题型:
【题目】淀粉溶液是一种胶体,并且淀粉遇到碘单质可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯中,过一段时间后,取烧杯中的液体进行实验,能证明半透膜完好无损的是
A.加入BaCl2溶液产生白色沉淀 B.加入碘水不变蓝
C.加入BaCl2溶液没有产生白色沉淀 D.加入碘水变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com