
科目: 来源: 题型:
【题目】下列现象与氢键无关的是( )
A. 小分子的醇、羧酸可以和水以任意比互溶
B. 冰的密度比液态水的密度小
C. 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
D. 水分子是很稳定的分子,加热到很高的温度都难以分解
查看答案和解析>>
科目: 来源: 题型:
【题目】目前国际空间站处理CO2废气涉及的反应为CO2+4H2![]() CH4+2H2O,该反应的下列说法正确的是( )
CH4+2H2O,该反应的下列说法正确的是( )
A. 达到平衡时,H2与CH4的体积之比为4 : l
B. 升高温度能减慢该反应的速率
C. 当断裂4molH-H键同时断裂4molO-H键,该反应达到平衡状态。
D. 当4V正(H2) = V逆(CH4) 时,该反应达到平衡状态。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列装置说法正确的是( )

A. 装置①中,盐桥中的Cl-移向ZnSO4溶液
B. 装置②工作一段时间后,b极附近溶液的pH增大
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关硫酸的性质,叙述正确的是( )
A.浓硫酸因具有吸水性,所以能使蔗糖炭化
B.实验室用浓硫酸与亚硫酸钠反应制SO2 , 体现浓硫酸的强氧化性
C.常温下,铁遇浓硫酸发生钝化,铁表面生成致密的氧化膜
D.浓硫酸作干燥剂,可以干燥H2、CO2、NH3、Cl2等气体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 化学反应除了生成新物质外,还伴随着能量的变化
B. 对于ΔH>0的反应,反应物的总能量小于生成物的总能量
C. 放热反应都不需要加热就能发生
D. 吸热反应在一定条件(如常温、加热等)下也能发生
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、 NH4+、H+、 N2、Cl-六种微粒。其中ClO-的物质的量随时间变化的曲线如图所示。下列判断正确的是( )

A. 该反应的还原剂是Cl- B. 反应后溶液的酸性明显增强
C. 消耗1mol还原剂,转移6 mol电子 D. 氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)═2H+(aq)+ ![]() O2(g)+2e﹣△H=+284kJ/mol
O2(g)+2e﹣△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e﹣═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=﹣1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式_________.
(2)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.
测得CO2和CH3OH(g)的浓度随时间变化如图1所示
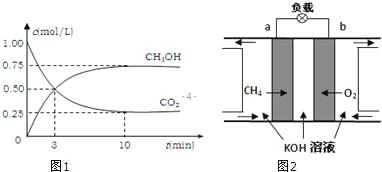
①一定温度下,不能说明该反应达到平衡状态的是:_________(填序号)
a.体系的压强不再改变
b.体系的密度不再改变
c.各气体的浓度不再改变
d.各气体的质量分数不再改变
e.反应速率v(CO2)正∶v(H2)逆=1∶3
②从反应开始到平衡,氢气的平均反应速率v(H2)=________mol/(Lmin);
③氢气的转化率=____________;
④该反应的平衡常数为K=_________保留三位有效数字);
⑤下列措施中能使平衡体系中n(CH3OH)/ n(CO2)增大的是________.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑥当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1____c2的关系(填>、<、=).
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池(在上面).请回答:
①通入甲烷一极的电极反应式为___________;
②随着电池不断放电,电解质溶液的pH______(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率____(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
④用该燃料电池以石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为____________________; 此时得到的O2在标准状况下的体积为______L;向电解后的溶液中加入下列哪种物质可使电解质溶液恢复原来的浓度:____________
A. CuSO4 B.H2O C.CuO D.CuCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中,氯离子的物质的量浓度是3molL﹣1的是( )
A.200mL 3molL﹣1 NaClO3溶液
B.100mL 2molL﹣1 FeCl3溶液
C.150mL 3molL﹣1 KCl溶液
D.150mL 1molL﹣1 MgCl2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂排放的污水只可能含Na+、K+、NH4+、Mg2+、Fe3+、SO32-、SO42-和Cl-中的几种(忽略由水电离产生的H+、OH-)。将试样平均分成甲、乙、丙各l00mL三份,每次均加入足量的试剂,设计如下实验。下列说法正确的是( )

A. 废水可能含有Na+、K+、Fe3+
B. 可能存在的离子用焰色反应进一步检验确认
C. 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol·L-1
D. 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com