
科目: 来源: 题型:
【题目】反应A2(g)+B2(g) →2AB(g)的能量变化如图所示,叙述正确的是

A. 该反应是放热反应
B. 加入催化剂,(b-a)的差值减小
C. 每生成2molAB分子吸收bkJ热量
D. 若反应生成AB为液态,吸收的热量小于(a-b)kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列数据:
物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:

①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3 min~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)反应中浓硫酸的作用是______________________________________;
写出制取乙酸乙酯的化学方程式:_____________________________。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是___________________;
步骤③所观察到的现象是_____________________________________;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应从仪器________(填“下口放”或“上口倒”)出。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是( )。
A.碳水化合物B.碳氢化合物C.氢气D.醇类
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是

A. X、Y、Z的原子半径大小:X>Y>Z
B. Y、Z的气态氢化物中,前者更稳定
C. Z、W的最高价氧化物对应水化物的酸性,前者更强
D. X、W的气态氢化物相互反应,生成物中既含离子键又含共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如图A所示。
方法三:利用红外光谱仪测得A分子的红外光谱如图B所示。请填空:
(1)A的分子式为________。
(2)A的分子中含一个甲基的依据是________(填选项字母)。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(3)写出符合题意的A的一种结构简式_______。
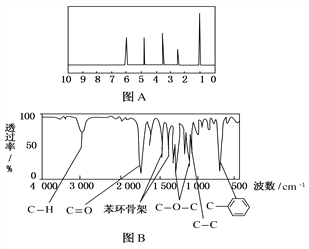
查看答案和解析>>
科目: 来源: 题型:
【题目】我市泉山森林公园被称为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”。O2-就是一种空气负离子,其摩尔质量为
A. 33 g B. 32 g C. 33 g·molˉ1 D. 32 g·molˉ1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)维生素A对人体特别是对人的视力有重要作用,其结构简式如下:

1 mol该化合物可与________mol Br2发生加成反应。
(2)在有机反应中,反应物相同而条件不同,可得到不同的主产物,下式中R代表烃基,副产物均已略去。

(请注意H和Br加成的位置)
请写出实现下列转变的各步反应的化学方程式,特别注意写明反应条件。
①由CH3CH2CH2CH2Br分两步转变为CH3CH2CHBrCH3:__________________;___________________。
②由(CH3)2CHCH===CH2分两步转变为(CH3)2CHCH2CH2OH:__________________;____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(12)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种化合物甲和乙。D、A按原子个数比3∶2形成化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是___________________________。
(2)A、B、C、D、E五种元素的原子半径由大到小的顺序是(用元素符号填写)_______________。
(3)写出E的最高价氧化物对应的水化物分别与A、C两元素的最高价氧化物对应的水化物反应的离子方程式:①_____________________________________;
_____________________________________。
(4)D、A按原子个数比3∶2形成化合物丙的化学式为____________。
(5)C、B可按原子个数比1∶1形成化合物乙的电子式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 钠和冷水反应Na+2H2O=Na++2OH-+H2↑
B. 金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑
C. 金属铝溶于盐酸中2Al+6H+=2Al3++3H2↑
D. 铁跟稀硫酸反应2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com