
科目: 来源: 题型:
【题目】下列各项叙述中正确的是
A. 同一原子中,能层序数越大,s原子轨道的形状相同,半径越大
B. 在同一能层上运动的电子,其自旋方向肯定不同
C. 镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态
D. 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
查看答案和解析>>
科目: 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:
4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) ΔH=-115.6 kJ/mol
2Cl2(g) + 2H2O(g) ΔH=-115.6 kJ/mol
恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是
A. 氯化氢的转化率不再改变 B. 气体的质量不再改变
C. 断开4 mol H-Cl键的同时生成4 mol H-O键 D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,pH=2的盐酸和醋酸各1 mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法不正确的是
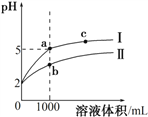
A. 曲线I代表盐酸的稀释过程
B. a溶液的导电性比c溶液的导电性强
C. a溶液中和氢氧化钠的能力强于b溶液
D. 将a、b两溶液加热至30℃,![]() 变小
变小
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,下列叙述正确的是

A. 放电过程中,电子从正极转移到负极
B. 放电过程中,H+从正极区移向负极区
C. 正极反应式为:MnO2+4H++2e- =Mn2++2H2O
D. 若C m(H2O)n是葡萄糖,当电路中转移了6NA电子时,消耗的葡萄糖是1mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g)2min 末,若测知以W 的浓度变化表示的反应速率为0.05molL﹣1min﹣1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,则:
(1)前2min内用Y的浓度变化表示的平均反应速率为___________。
(2)2min末时X的浓度为_________。
(3)化学反应方程式中n的值是____________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知原子序数依次增大的X、Y、Z、D、E、F六种前四周期元素。X是宇宙中最丰富的元素;Y和Z基态原子的未成对电子数均等于周期序数;D的氧化物是典型的两性氧化物;E是所在周期中电负性最大的元素;F的单质是一种紫红色金属,在潮湿空气中该金属表面会慢慢生成一种绿色固体。请回答下列问题(用元素符号或化学式表示):
(1)X元素位于周期表的________区。
(2)基态D原子的价电子轨道表示式是______,其第一电离能反常地低于同周期前一种元素,原因是_______。
(3)YZ2分子的电子式是__________,该分子的空间构型是_____________。
(4)甲是由X、Y、Z三种原子构成的含有16个电子的分子,甲中Y原子的杂化类型是_______,它能溶于水的原因是______________。
(5)金属F与XE的热浓溶液反应产物之一是X3[FE4],该反应的化学方程式是______________。
(6)F与Z形成的一种晶胞结构如图,其中F原子均匀地分散在立方体内部,原子a、b、d的坐标参数依次为(0,0,0)、(![]() ,
, ![]() ,
, ![]() )、(3m,3m,3m),则m=________。已知该晶体的密度为ρg/cm3, NA是阿伏伽德罗常数值,则原子b和d之间的核间距是__________nm(列出计算式即可)。
)、(3m,3m,3m),则m=________。已知该晶体的密度为ρg/cm3, NA是阿伏伽德罗常数值,则原子b和d之间的核间距是__________nm(列出计算式即可)。

查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列说法正确的是
A. 用惰性电极电解NaH2PO2溶液,其阳极反应式为2H2O+4e-![]() O2↑+4H+
O2↑+4H+
B. 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物可能为H3PO4
C. H3PO2溶于水的电离方程式为H3PO2![]() H++H2PO2-
H++H2PO2-
D. H3PO2与过量NaOH溶液反应的离子方程式为H3PO2+3OH-![]() PO23-+3H2O
PO23-+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com