
科目: 来源: 题型:
【题目】25℃时,部分含Fe元素的徽粒在溶液中的物质的量分数与溶液pH的关系如图所示,下列说法正确的是

A. HFeO4-在水中的电离程度小于水解程度
B. B、C两点对应溶液中水的电离程度:B > C
C. B点溶液加适里水稀释,溶液中所有离子浓度均减小
D. 由A点数据可知,H2FeO4的第一步电离平衡常数Ka1=4.15×l0-4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列用品的主要成分不正确的是
A | B | C | D | |
用品 | 水玻璃 | “84”消毒液 | 食用纯碱 | 复方氢氧化铝片 |
主要成分 | Na2SiO3 | NaClO | NaHCO3 | Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于等电子体的说法中,正确的是
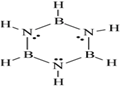
A. N2与CO不属于等电子体,故它们的熔沸点、溶解度相差较大
B. PO43-与SO42-不属于等电子体,故结构不相似
C. NO2-与O3属于等电子体,故NO2-为O2的同素异形体
D. 苯与硼氮苯(路易斯结构式如上图)属于等电子体,故硼氮苯中含有大π键
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B) ∶n(C)=2∶2∶l。保持温度不变,以2∶2∶1的物质的量之比再充入A,B,C,则( )
2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B) ∶n(C)=2∶2∶l。保持温度不变,以2∶2∶1的物质的量之比再充入A,B,C,则( )
A. 平衡向正方向移动 B. 平衡不发生移动
C. C的体积分数减小 D. C的体积分数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除杂的方法中,正确的是
A. 除去乙烷中少量的乙烯:光照下通入Cl2,生成液态CH2Cl-CH2Cl,气液分离
B. 除去甲苯中的苯甲酸:加入NaOH溶液后,静置分液
C. 除去乙酸乙酯中的乙酸:用NaOH溶液中和,然后蒸馏
D. 除去乙醇中少量的水:加入生石灰,然后蒸馏
查看答案和解析>>
科目: 来源: 题型:
【题目】足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为
A.3︰2 B.1︰2 C.3︰1 D.6︰1
查看答案和解析>>
科目: 来源: 题型:
【题目】0.1mol分子式为CmHn的有机化合物在氧气中完全燃烧,生成CO2和H2O的物质的量相等,并消耗标准况下16.8L氧气。
(1)该有机化合物的分子式。_______
(2)若分子中只有两个甲基(-CH3)且属于不饱和烃,写出其结构简式并命名_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有反应 3Fe(s)+ 4 H2O(g)![]() Fe3O4(s)+4 H2(g),在一体积可调的密闭容器中进行,采取下列措施对其反应速率几乎无影响的是( )
Fe3O4(s)+4 H2(g),在一体积可调的密闭容器中进行,采取下列措施对其反应速率几乎无影响的是( )
A. 增加H2的量
B. 将容器体积缩小一半
C. 保持容器内体积不变,充入Ar使体系压强增大
D. 充入Ar,保持容器内压强不变
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
⑴写出基态Zn原子的价电子排布式__________,基态S原子核外未成对电子数为_____。
⑵ZnSO4中三种元素的电负性由大到小的顺序为_____________________,SO42-的立体构型为________________,其中S的杂化轨道类型为_________。
⑶硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有___________。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
⑷根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为___________;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
⑸立方ZnS晶体的密度为ρg·cm-3,其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知NO2和N2O4的结构式如右图所示。已知:N—N的键能为a kJ/mol,NO2和N2O4中N=O键键能分别是b kJ/mol和c kJ/mol。写出NO2转化为N2O4的热化学方程式________________(△H用a、b、c的代数式表示)。

(2)在100℃时,将0.4mol NO2放入2L的真空容器中发生反应:2NO2![]() N2O4。测得容器内气体的物质的量随时间变化如下表:
N2O4。测得容器内气体的物质的量随时间变化如下表:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①上述条件下,前20s内以NO2表示的平均化学反应速率为_________________________;达到平衡状态时,NO2的转化率是________。
②n2_______ n3(填“>”、“=”、“<”)。
③80s时,向容器内加入NO2和N2O4各0.24mol,化学平衡将_________(填“向正反应方向移动”、“ 向逆反应方向移动”、“不移动”)。
④若将NO2的起始物质的量改为0.2mol,在相同条件下进行实验,要想达到与上述平衡相同的平衡状态,则起始时还需要加入适量的N2O4气体,则N2O4的浓度为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com