
科目: 来源: 题型:
【题目】下列有关卤族元素与0族元素的说法正确的是
A. 卤族元素易与第ⅠA族元素形成盐
B. 0族元素可统称为稀有气体元素
C. XeF6中Xe的化合价为0,因为Xe是0族元素
D. 砹(At)是第ⅦA元素,其固体单质的分子式为At
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:
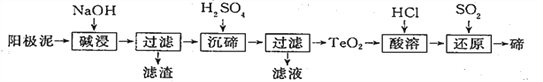
已知TeO2微溶于水,易溶于较浓的强酸和强喊。
(1)“碱浸”时发生反应的离子方程式为____________________。
(2)碱浸后的“滤渣”可以部分溶于稀硝酸,发生反应的化学方程式是______________。
(3)“沉碲”时控制溶液的pH为4. 55. 0,生成TeO2沉淀。酸性不能过强,其原因是_______________;防止局部酸度过大的操作方法是_________。
(4)“酸溶”后,将SO2通人TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是__________。
(5)25°C 时,亚碲酸(H2TeO3) 的Ka1=1×10-3,Ka2=2×10-8。
①0.1 mol·L-1 H2TeO3电离度α约为_____________。(α=![]() ×100%)
×100%)
②0. lmol L-1的NaH TeO3溶液中,下列粒子的物质的量浓度关系正确的是___________。
A.c(Na+ )>c(HTeO3- )>c(OH-)>c(H2TeO3)>c(H+ )
B.c(Na+) + c( H+) >= c(HTeO3- ) +c(TeO32-) +c(OH- )
C.c(Na+ ) =c(TeO32-) +c( HTeO3-) + c( H2TeO3)
D.c(H+)+c(H2TeO3)=c(OH-)+e(TeO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】将3.2g铜跟30mL1mol/L的硝酸充分反应,还原产物有NO和NO2,反应后的溶液中有amolH+,则此时溶液中含有NO3-的物质的量为
A. 0.5amol B. (0.1+a)mol C. 0.1amol D. 2amol
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. 溶液中OH-向电极a移动
B. 反应消耗的NH3与O2的物质的量之比为4:3
C. 负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
D. 电子迁移方向:电极a→导线→电极b→电解质溶液→电极a
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸铵可用作化肥、军用炸药、杀虫剂、冷冻剂,工业制取硝酸铵的工艺流程如下:

(1)N2分子的电子式为_____,NH3分子中含有的化学键类型是____________。
(2)乙装置中发生反应的化学方程式是_________,标准状况下,该反应生成2.24LNO气体转移的电子数目为______。
(3)生产硝酸排放的尾气中常含有NO、NO2,可用以下两种方法处理:
方法一:碱液吸收法。写出用其氧化钠溶液吸收NO、NO2生成亚硝酸钠的离子方程式_________。
方法二:甲烷吸收法。在恒压条件下,将一定量的CH4和NO2两种气体置于密闭容器中,发生CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有______(填字母)。
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有______(填字母)。
A.增加催化剂表面积 B.减小投料比:n(NO2)/n(CH4)
C.增大压强 D.升高温度
(4)配制100mL0.1mol·L-1NH4NO3溶液所需要的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和______。
(5)25℃时,下列关于硝酸铵溶液中的离子浓度关系不正确的是_____ 。
A.Kw/c(H+)>1×10-7mol·L-1 B.c(NO3-)>c(NH4+)>c(H+)>c(OH-)
C.c(H+)=c(OH-)+c(NH3·H2O) D.c(NH4+)+c(H+)=c(NO3-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇又称“木精”,是非常重要的化工原料。
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇。根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式______。
化学键 | H-H | O-H | C-H | C-O | C=O |
键能/KJ·mol-1 | 436 | 463 | 413 | 351 | 1076 |
(2)甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。

①该脱氢反应的ΔH___0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)___V(逆)(填“>”、“<”或“=”),判断依据是_____
③下列叙述不能说明该脱氢反应已经达到平衡状态的是_____。
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸。已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13。
常温下,将20mL0.10mol·L-1CH3COOH溶液和20mL0.10mol·L-1HSCN溶液分别与20mL0.10mol·L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如下图所示:

①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是_______,反应结束后所得两溶液中,C(CH3COO-)____ c(SCN-)(填“>”、“<”或“=”)。
②常温条件下,将amol·L-1的CH3COOH与bmol·L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_______。
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体电极的电极反应式为___________。

查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W为原子序数递增的四种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(关系图中“—”相连的两种物质能发生反应)。下列判断正确的是

A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 四种原子中,Y原子半径最小 D. W的简单阴离子可能促进水的电离
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是

A. 含有AgBr和AgI固体的悬浊液:c(Ag+)>c(Br-)=c(I-)
B. 25℃时,0.1mol·L-1醋酸溶液PH=a,0.01mol·L-1醋酸溶液PH=b,则b=a+1
C. 常温下,右图表示以酚酞作指示剂,用0.1mol·L-1NaOH溶液滴定未知浓度的盐酸,滴定至终点时,溶液一定呈中性
D. 向0.1mol·L-1的氨水中加入硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是( )
A. 木已成舟 B. 铁杵成针 C. 蜡炬成灰 D. 滴水成冰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com