
科目: 来源: 题型:
【题目】伞形酮可用作荧光指示剂和酸碱指示剂。其合成方法为
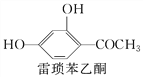

下列说法不正确的是( )
A. 雷琐苯乙酮、苹果酸和伞形酮各1 mol与足量Na反应生成H2体积之比为2∶3∶1
B. 雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应
C. 1 mol雷琐苯乙酮跟足量H2反应,最多消耗4 mol H2
D. 1 mol伞形酮与足量NaOH溶液反应,最多消耗2 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】将含有等体积NH3、CO2、NO的混合气体依次通过盛有浓H2SO4、Na2O2和Na2CO3溶液的装置,充分作用后,最后得到的气体是( )
A. CO2和NO B. CO2 C. NO D. NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
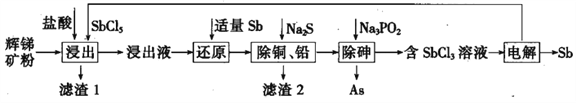
已知:① 浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_________________。
(3)“还原”时,被Sb还原的物质为_____________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于______;所加Na2S也不宜过多,其原因为_____________。
(5)“除砷”时有H3PO3生成,该反应的化学方程式为________________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_______。
(7)一种突破传统电池设计理念的镁-锑液态金属储能电池工作原理如图所示:

该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,C1-向_____(填“上”或“下”)移动;放电时,正极的电极反应式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4mol·L-1的浓硫酸配制250mL 4.8 mol·L-1的硫酸溶液,需量取浓硫酸___________mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_________。
(2)酸浸时,为了提高浸取率可采取的措施有____________________________。(答出两点)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4 (>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.滤液Ⅱ中阳离子主要有_________;但溶液的pH不能超过8,其理由是_______________________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是__________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:______________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)写出H2CO3的电离方程式:______________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是______________________(填宇母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH)
C. c(H+)·c(OH-) D. 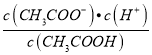
若该溶液升髙温度,上述4种表达式的数据增大的是_________________________。
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
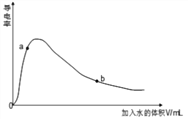
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同, 则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关系正确的是
A. 密度:CCl4>CHCl3>H2O>苯
B. 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷
C. 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷
D. 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸
查看答案和解析>>
科目: 来源: 题型:
【题目】对于CO2+3H2![]() CH3OH+H2O,下列说法能判断该反应达到平衡状态的是
CH3OH+H2O,下列说法能判断该反应达到平衡状态的是
A. v(CO2)= ![]() v(H2) B. 3v逆(H2)=v 正(H2O)
v(H2) B. 3v逆(H2)=v 正(H2O)
C. v正(H2)=3v逆(CO2) D. 断裂 3molH-H 键的同时,形成 2molO-H 键
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物是形成酸雨的成因之一,与其他污染物在一定条件下能产生光化学烟雾,加大对氮氧化物的处理是环境治理的重要研究内容。
(1)NH3催化NOx是目前应用最广泛的烟气氮氧化物脱除技术。
已知.①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H1
2N2(g)+6H2O(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③H2O(g)=H2O(l) △H3
则反应4NH3(g)+6NO(g)![]() N2(g)+6H2O(l) △H=______(用含△H1、△H2和△H3的式子表示)。
N2(g)+6H2O(l) △H=______(用含△H1、△H2和△H3的式子表示)。
(2)科学家用活性炭还原法可以消除NO的污染,发生的反应为C(s)+2N0(g)![]() N2(g)+CO2(g)。lmolNO和足量的活性炭在T℃、容积恒定为1L的密闭容器中反应,经过10min反应达到平衡,测得NO的物质的量为0.5mol。
N2(g)+CO2(g)。lmolNO和足量的活性炭在T℃、容积恒定为1L的密闭容器中反应,经过10min反应达到平衡,测得NO的物质的量为0.5mol。
①10min内,平均反应速率v(N2)=______,在T℃时,该反应的平衡常数K=_______。
②能判断该反应一定达到化学平衡状态的依据是______(填标号)。
a.单位时间内生成2nmolNO的同时消耗nmolCO2
b.反应体系的温度不再发生改变
c.恒容条件下,混合气体的密度不再发生改变
d.恒温恒容条件下,反应体系的压强不再发生改变
(3)电化学住化净化NO是一种新颖的处理氮氧化物的方法。原理如下图,固体电解质起到传导O2-的作用,则通入NO的电极反应式为________。

(4)已知:25℃时,HNO2的电离常数Ka=7.1×10-4,CH3COOH的电离常数K=1.8×10-5,实验室时可用NaOH溶液吸收NO2,生成NaNO3和NaNO2。②③
①已知溶液甲为浓度均为0.1mol· L-1,的NaNO3和NaNO2的混合溶液,溶液乙为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_______,能使溶液甲和溶液乙的pH相等的方法是_______(填标号)。
a.向溶液甲中加适量水 b. 向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d. 向溶液乙中加适量NaOH
②25℃时,向0.1mol·L-1CH3COOH溶液中加入一定量的CH3COONa溶液,使溶液中c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在生产生活中用途广泛。请回答:
I.在微生物作用下,土壤中的NH4+最终被O2氧化为NO3-,该反应的离子方程式为________。
Ⅱ.氨气是重要的化工原料。已知:25℃时,NH3·H2O的电离常数kb=1.79×10-5,该温度下,1.79mol/LNH4Cl溶液的pH约为_____________。
Ⅲ.汽车在行驶过程中有如下反应发生:
ⅰ.N2(g)+O2(g)![]() 2NO(g) △H=+180.7kJ/mol
2NO(g) △H=+180.7kJ/mol
ⅱ.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.5kJ/mol
N2(g)+2CO2(g) △H=-746.5kJ/mol
(1)能表示CO燃烧热的热化学方程式为__________________。
(2)反应ⅱ在________(填“较高”或“较低”)温度下能自发进行。
(3)T温度时,向10L恒容密闭容器中充入2molNO和2molCO发生反应ii,5min时达到平衡,测得0~5min内该反应速率v(N2)=0.016mol·L-1·min-1。
①T温度时,该反应的平衡常数K=____________________。
②平衡时容器内压强与起始时容器内压强之比为_________________。
(4)一定条件下,向起始容积为5L的恒压密闭容器充入1molN2和1molO2发生反应i。O2的平衡转化率(α)与温度(T)的关系如图1所示;正反应的平衡常数(K)与温度(T)的关系如图2所示。
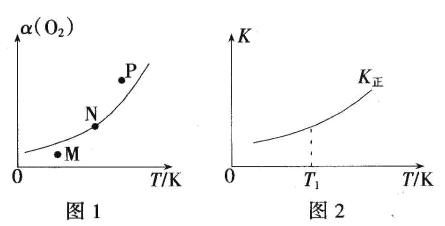
①图1中,M、N、P三点所对应的状态下,v(正)>v(逆)的是_______(填字母),理由为______。
②T1温度时,K正=1,则O2的平衡转化率为________(保留三位有效数字);在图2中画出逆反应平衡常数(K逆)与温度(T)的关系曲线。________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com