
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 碳酸钙与醋酸反应:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
B. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
C. NaHCO3溶液显碱性:HCO3-+H2O=CO32-+H3O+
D. 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于铷(Rb)的叙述不正确的是
A. 位于周期表的第五周期第IA族B. 氢氧化铷是一种强碱
C. 钠、钾、铷单质的还原性依次减弱D. 硝酸铷易溶于水且全部电离
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化合物在一定条件下,既能发生消去反应,又能发生水解反应的是( )
A.CH3Cl B.CH3CH(Br)CH3 C.(CH3)3C—CH2Cl D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】有关天然产物水解叙述不正确的是
A、油脂水解可得丙三醇
B.可用碘检验淀粉是否水解完全
C、蛋白质水解的最终产物均为氨基酸
D.纤维素水解和淀粉水解得到的最终产物不同
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)写出“溶解”过程中发生的氧化还原反应的离子方程式(N元素被还原到最低价):_______,溶解温度应控制在60-70℃,原因是_______。
(2)写出步骤③中,氧化剂与还原剂的物质的量之比为________。已知NH4Cl、Cu2+的物质的量之比[n(NH4Cl)/n(Cu2+)]与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定程度后的氯化亚铜的沉淀率减少,其可能的原因是__________。

(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____(写名称),回收的主要物质是____(写化学式)
(4)上述工艺中,步骤⑥醇洗的作用是__________。
(5)称取2.000g CuCl样品(杂质不参与反应),溶于一定量的0.5000mol/L FeCl3溶液中,加水稀释至200mL得到溶于,取20.00mL用0.1000mol/L的Ce(SO4)2溶液滴定到终点,消耗20.00mL Ce(SO4)2
有关反应式:Fe3++CuCl═Fe2++Cu2++Cl﹣ Ce4++Fe2+═Fe3++Ce3+
则样品中CuCl的质量分数_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚乙烯醇肉桂酸酯H广泛用于制备集成电路、电子元件等。其结构简式如图所示: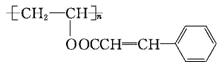 。下列是聚乙烯醇桂酸酯的一种合成路线
。下列是聚乙烯醇桂酸酯的一种合成路线

已知:
请回答下列问题:
(1)E的名称是____________,H中含氧官能团的名称是___________。
(2)④的反应类型是________,G的反应式结构简式为_____________。
(3)写出反应⑥的化学方程式___________________________________。
(4)T是G的同分异构体,同时具有下列性质的T的结构有_____种(不考虑立体异构和顺反异构)。
①遇氯化铁溶液发生显色反应;②能发生加聚反应;③能发生银镜反应。
其中核磁共振氢谱上有6组峰,且峰面积之比为1∶1∶1∶1:2∶2的有机物的结构简式为_____。
(5)参照上述流程信息,以苯乙炔、乙醇为原料制备化工产品: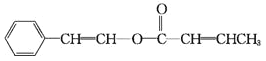 设计合成路线。
设计合成路线。
_______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】分别向盛有①紫色石蕊溶液 ②NaOH溶液 ③品红溶液 ④酸性高锰酸钾溶液的试管中通入SO2气体。
(1)试管①中的现象:___________发生反应的化学方程式是:_________________。
(2)试管②中发生反应的化学方程式是:_____________________,如果通入过量的SO2,则发生反应的化学方程式为:_______________________________。
(3)试管③中的现象:________,如将吸收SO2后的该溶液加热,现象:______________。
(4)试管④中的现象:____________________。
(5)上述实验中,SO2表现出酸性氧化物性质的是___________(填试管标号,下同),SO2表现出漂白性的是___________。SO2表现出还原性的是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并___________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如右图所示,所用盐酸溶液的体积为________mL。
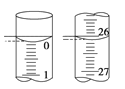
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度________________。
查看答案和解析>>
科目: 来源: 题型:
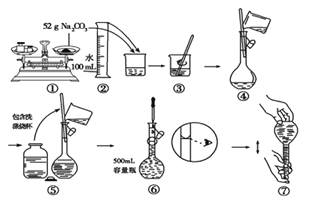
【题目】I、某同学用Na2CO3配制500mL 1.0mol/L Na2CO3溶液的过程如图所示(第⑤步小口瓶中为蒸馏水)。你认为该同学配制溶液的明显错误有(填实验步骤的序号)_______, 所配溶液的浓度(填“低于”、“等于”或“高于”)________ 1.0mol/L。
Ⅱ、一化学兴趣小组,探究从某工业废水(含有大量的FeSO4、较多的Cu2+和少量的Na+)中回收FeSO4制备绿矾(FeSO4·7H2O),同时回收金属铜的方法,以减少污染并交废为宝。以下是他们设计出的回收流程图,回答有关问题。
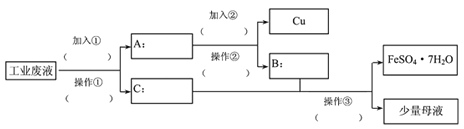
(1)加入的①为(填物质名称)_________,加入②后的离子反应为________。
(2)操作②的名称为_____________。
(3)操作③为蒸发浓缩,降温结晶,过滤,用50%的酒精溶液洗涤绿矾晶体。洗涤FeSO4·7H2O晶体时,用50%的酒精洗涤而未用蒸馏水洗涤的原因是_____________。
(4)母液中含有的离子有(填离子符号): _____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水。某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如下图所示。请回答下列问题:

(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到的目的是 (填序号)
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是 ,设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式 ,装置D中NaOH全部转化为NaHSO3的标志是____________
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完; Ⅱ.NaClO不足; Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 加入几小块CaCO3固体 | 有气泡产生 | |
② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
③ | 滴加少量溴水,振荡 | Ⅱ | |
④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
(4)设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com