
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)写出“溶解”过程中发生的氧化还原反应的离子方程式(N元素被还原到最低价):_______,溶解温度应控制在60-70℃,原因是_______。
(2)写出步骤③中,氧化剂与还原剂的物质的量之比为________。已知NH4Cl、Cu2+的物质的量之比[n(NH4Cl)/n(Cu2+)]与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定程度后的氯化亚铜的沉淀率减少,其可能的原因是__________。

(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____(写名称),回收的主要物质是____(写化学式)
(4)上述工艺中,步骤⑥醇洗的作用是__________。
(5)称取2.000g CuCl样品(杂质不参与反应),溶于一定量的0.5000mol/L FeCl3溶液中,加水稀释至200mL得到溶于,取20.00mL用0.1000mol/L的Ce(SO4)2溶液滴定到终点,消耗20.00mL Ce(SO4)2
有关反应式:Fe3++CuCl═Fe2++Cu2++Cl﹣ Ce4++Fe2+═Fe3++Ce3+
则样品中CuCl的质量分数_________。
【答案】 Cu+NO3-+10H+=4Cu2++NH4++3H2O 温度低溶解速度慢,温度过高铵盐分解 2:1 生成的CuCl有溶解于氯化铵溶液中 硫酸 (NH4)2SO4 醇洗有利于加快除去CuCl表面水分防止其水解氧化 99.50%
【解析】酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,烘干得到氯化亚铜;
(1)由于酸性条件下硝酸根离子具有氧化性,可氧化Cu生成Cu2+,N元素被还原到最低价,即硝酸根离子的还原产物为NH4+,根据电子守恒、电荷守恒及原子守恒可得反应的离子方程式为Cu+NO3-+10H+=4Cu2++NH4++3H2O;溶解温度应控制在60-70℃,原因是温度低溶解速度慢,温度过高铵盐分解;
(2)步骤③中铜离子与亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,氧化剂与还原剂的物质的量之比为2:1;当氯化铵用量增加到一定程度后氯化亚铜的沉淀率减少,原因是生成的氯化亚铜又溶解于氯化铵溶液中;
(3)由流程可知,经酸洗、水洗后得到硫酸铵,则应加入硫酸,为防止CuCl溶解,不能加入硝酸等氧化性酸,也不能加入盐酸,防止引入新杂质;可回收的主要物质是(NH4)2SO4;
(4)步骤⑥为醇洗,因乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,;
(5)根据Fe3++CuCl═Fe2++Cu2++Cl﹣ Ce4++Fe2+═Fe3++Ce3+可知存在关系式:CuCl~~~~~Fe2+~~~~~~~~Ce4+,
用0.1000mol/L的Ce(SO4)2溶液滴定到终点,消耗20.00mL Ce(SO4)2,则Ce4+的物质的量为0.1000mol/L×0.02L=0.002mol,故CuCl的物质的量为0.002mol,样品中CuCl的质量分数![]() ×
×![]() ×100%=99.50%。
×100%=99.50%。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】具有特殊功能高分子材料的开发和利用,越来越成为科学家研究的方向。下图是合成具有特殊功能高分子材料W的流程:

已知:(R、R1、R2、R3代表烃基)

(1)反应①的反应类型是____________________。
(2)反应②是取代反应,其化学方程式是____________________。
(3)D的核磁共振氢谱中有两组峰且面积之比是1:3,不存在顺反异构。D的结构简式是_______________;分子式符合C4H8,属于烯烃的同分异构体共有__________种(含顺反异构)。
(4)反应⑤的化学方程式是____________________。
(5)G的结构简式是____________________。
(6)反应⑥的化学方程式是____________________。
(7)工业上也可用 合成E。____________________由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,
合成E。____________________由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,  不易发生取代反应)。
不易发生取代反应)。

查看答案和解析>>
科目:高中化学 来源: 题型:
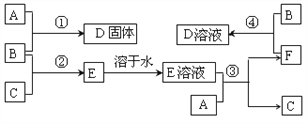
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可按下面框图进行反应。又知E溶液是无色的。
请回答:
(1)A是____________,B是____________,C是_____________。(填化学式)
(2)反应①的化学方程式为________________________________________
(3)反应③的化学方程式为________________________________________
(4)反应④的化学方程式为________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
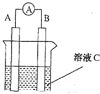
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32-4e-=4CO2,正极反应式为________________________,电池总反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水。某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如下图所示。请回答下列问题:

(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到的目的是 (填序号)
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是 ,设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式 ,装置D中NaOH全部转化为NaHSO3的标志是____________
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完; Ⅱ.NaClO不足; Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 加入几小块CaCO3固体 | 有气泡产生 | |
② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
③ | 滴加少量溴水,振荡 | Ⅱ | |
④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
(4)设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列有关说法正确的是( )
A. 英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2
B. 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放人生石灰
C. 二氧化硫有毒,严禁将其添加到任何食品和饮料中
D. 泡沫灭火器中用的是小苏打和硫酸铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验操作的叙述中正确的是( )
A. 从试剂瓶中取出任何药品,若有剩余一定不能再放回原试剂瓶中
B. 可燃性气体点燃之前必须验纯
C. 用胶头滴管向试管中滴加液体,一定要将滴管伸入试管内
D. 用温度计搅拌溶液一定要慢慢搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是巨大的资源宝库,下面是海水资源综合利用的部分流程图。
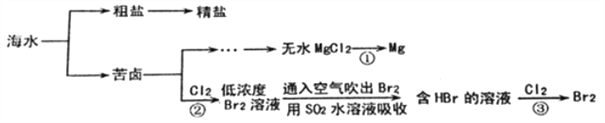
(1)从海水中获得粗盐的方法是____________________。
(2)粗盐中含有Ca2+、Mg2+、SO42- 等杂质离子,制取精盐的过程中需依次除去这些离子,所加除杂试剂依次是氢氧化钠溶液、_________________和________________。
(3)①中反应的化学方程式是________________。
(4)③中反应的离子方程式是________________________,生成1molBr2转移电子________mol。
(5)由以上过程可知,Cl2、SO2、Br2的氧化性由强到弱的顺序是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com