
����Ŀ����������ܸ߷��Ӳ��ϵĿ��������ã�Խ��Խ��Ϊ��ѧ���о��ķ�����ͼ�Ǻϳɾ�������ܸ߷��Ӳ���W�����̣�

��֪����R��R1��R2��R3����������

��1����Ӧ�ٵķ�Ӧ������____________________��
��2����Ӧ����ȡ����Ӧ���仯ѧ����ʽ��____________________��
��3��D�ĺ˴Ź���������������������֮����1:3,������˳���칹��D�Ľṹ��ʽ��_______________������ʽ����C4H8������ϩ����ͬ���칹�干��__________�֣���˳���칹����
��4����Ӧ�ݵĻ�ѧ����ʽ��____________________��
��5��G�Ľṹ��ʽ��____________________��
��6����Ӧ�Ļ�ѧ����ʽ��____________________��
��7����ҵ��Ҳ���� �ϳ�E��____________________��������~�ܵĺϳ�·���л�ȡ��Ϣ��������кϳ�·�ߣ���ͷ��ע���Լ��ͷ�Ӧ������
�ϳ�E��____________________��������~�ܵĺϳ�·���л�ȡ��Ϣ��������кϳ�·�ߣ���ͷ��ע���Լ��ͷ�Ӧ������  ������ȡ����Ӧ����
������ȡ����Ӧ����

���𰸡� �ӳɷ�Ӧ BrCH2CH2Br +2NaCN�� NCCH2CH2CN + 2NaBr (CH3)2C=CH2 4 CH2=C(CH3)COOH +HOCH3 ![]() CH2=C(CH3)COOCH3 + H2O
CH2=C(CH3)COOCH3 + H2O 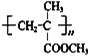
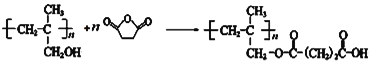
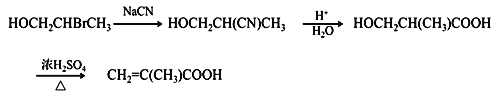
����������1����Ӧ������ϩ����ļӳɷ�Ӧ����2��A�Ľṹ��ʽΪCH2BrCH2Br����Ӧ����ȡ����Ӧ������B�ķ���ʽ��֪�仯ѧ����ʽ��BrCH2CH2Br +2NaCN��NCCH2CH2CN + 2NaBr��(3)D�ĺ˴Ź���������������������֮����1:3��������˳���칹����˸���D�ķ���ʽ��֪D�Ľṹ��ʽ��(CH3)2C=CH2������ʽ����C4H8������ϩ����ͬ���칹�干��1����ϩ��2����ϩ����˳���칹����2������ϩ������4�֡���4������W�Ľṹ��ʽ�������֪��Ϣ��֪I�Ľṹ��ʽΪ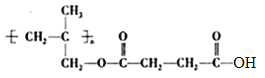 ��������֪��Ϣ��֪H�Ľṹ��ʽΪ
��������֪��Ϣ��֪H�Ľṹ��ʽΪ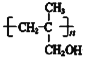 ��G�Ľṹ��ʽΪ
��G�Ľṹ��ʽΪ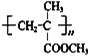 �����F�Ľṹ��ʽΪCH2=C(CH3)COOCH3����E�Ľṹ��ʽΪCH2=C(CH3)COOH�����Է�Ӧ�ݵĻ�ѧ����ʽ��CH2=C(CH3)COOH +HOCH3
�����F�Ľṹ��ʽΪCH2=C(CH3)COOCH3����E�Ľṹ��ʽΪCH2=C(CH3)COOH�����Է�Ӧ�ݵĻ�ѧ����ʽ��CH2=C(CH3)COOH +HOCH3![]() CH2=C(CH3)COOCH3+H2O��(5)�������Ϸ�����֪G�Ľṹ��ʽ��
CH2=C(CH3)COOCH3+H2O��(5)�������Ϸ�����֪G�Ľṹ��ʽ��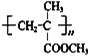 ��(6)��Ӧ�Ļ�ѧ����ʽ��
��(6)��Ӧ�Ļ�ѧ����ʽ��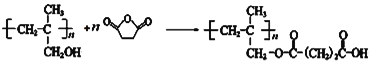 ����7��������֪��Ϣ��������Ʒ���֪��֪��ϳ�·��ͼΪ
����7��������֪��Ϣ��������Ʒ���֪��֪��ϳ�·��ͼΪ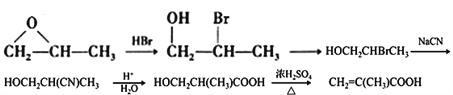 ��
��


 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������⾷ҩ����Ч�ɷ����������أ���ṹ��ʽ��ͼ��ʾ�����й����������ص�˵���У���ȷ����

A. �������صķ���ʽΪC12H12O5
B. 1mol������������ܺ�2molNaOH��Ӧ
C. 1mol������������ܺ�4molH2�����ӳɷ�Ӧ
D. ����������һ�������¿��������ᷢ��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����ɵ���ֱ�ӻ��϶��ɵ������� ( )
A. FeCl2 B. CuCl2
C. AlCl3 D. NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˷�ֹFeSO4�����������ʣ�ʵ����������FeSO4��Һʱ��������Һ�м��������ģ� ��
A. ͭ�� B. ���� C. п�� D. Fe2��SO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵıȽϣ�������Ԫ�������ɽ��͵���
A. ԭ�Ӱ뾶��C > O B. ���ԣ�HCl > H2SiO3
C. ���ȶ��ԣ�H2O > H2S D. �����ԣ�Na > Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϣ��û���ͭ���������£�

����˵������ȷ����
A. ͭ�����ղ�����β�����ð�ˮ�����Ƴɻ�����Ʒ
B. ��ⷨ������ͭ�Ĺ����У�������ͭ��Һ���������Һ
C. ��Cu2O�� CO��Ӧʱ��CO����ԭ��CO2
D. ��ͭ����ʱ�����ؽ��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���������һ������ʹ�ʻ���ɫ
B. �������������ᷴӦ��ֻ�����κ�ˮ
C. ������ˮ������ȥ���۶������õ�ˮ��ԭ��
D. ��Ԫ�����ڱ����·�����Ľ���Ԫ���п���Ѱ������뵼��IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д������(����)
A. Ԫ�����ڱ�����7�����塢7�����塢0��͢���
B. ϡ������Ԫ��ԭ�ӵ�������������Ϊ8
C. ����ԭ��������С��Ԫ��
D. ��Ԫ��λ�ڵڶ����ڢ�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��CuCl���㷺Ӧ���ڻ�����ӡȾ����Ƶ���ҵ��CuCl�����ڴ���ˮ��������������Ũ�Ƚϴ����ϵ���ڳ�ʪ��������ˮ���������Ժ���ͭ����Ҫ�ɷ���Cu������CuO��Ϊԭ�ϣ���������������ֽ⼼������CuCl�Ĺ��չ������£�

�ش��������⣺
��1��д�����ܽ��������з�����������ԭ��Ӧ�����ӷ���ʽ��NԪ�ر���ԭ����ͼۣ���_______���ܽ��¶�Ӧ������60-70�棬ԭ����_______��
��2��д��������У��������뻹ԭ�������ʵ���֮��Ϊ________����֪NH4Cl��Cu2+�����ʵ���֮��[n(NH4Cl)/n(Cu2+)]��Cu2+�����ʵĹ�ϵ��ͼ��ʾ�����Ȼ���������ӵ�һ���̶Ⱥ���Ȼ���ͭ�ij����ʼ��٣�����ܵ�ԭ����__________��

��3������ݰ�����pH=2����ϴ��ˮϴ������������ϴ���õ�����_____��д���ƣ������յ���Ҫ������____��д��ѧʽ��
��4�����������У������ϴ��������__________��
��5����ȡ2.000g CuCl��Ʒ�����ʲ����뷴Ӧ��������һ������0.5000mol/L FeCl3��Һ�У���ˮϡ����200mL�õ����ڣ�ȡ20.00mL��0.1000mol/L��Ce(SO4)2��Һ�ζ����յ㣬����20.00mL Ce(SO4)2
�йط�Ӧʽ:Fe3++CuCl�TFe2++Cu2++Cl�� Ce4++Fe2+�TFe3++Ce3+
����Ʒ��CuCl����������_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com