
【题目】为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的( )
A. 铜粉 B. 铁粉 C. 锌粉 D. Fe2(SO4)
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】⑴同分异构现象是有机化合物种类繁多的重要原因,正确识别和判断同分异构体是学习有机化学的重要能力。
①下列分子式表示的物质中有同分异构体的是___________。
A.CH4O B.C2H4 C.C2H5Cl D.C2H4O2
②利用核磁共振氢谱可判断出分子式为C2H6O的有机物有两种同分异构体,在核磁共振氢谱上有一种特征峰的有机物的结构简式是___________________。
③已知C4H9Cl共有四种结构,则分子式为C5H10O的醛有___________种同分异构体。
⑵充分燃烧2.8 g某有机物A,生成8.8 g CO2和3.6 g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍,该有机物的分子式为________.若该有机物没有甲基,则其结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A、B为原料制备现行高分子化合物M和抗凝血药物N的一种路线如下(部分反应条件和试剂略去)

已知:Ⅰ.烃A的密度是相同条件下H2密度的14倍;
Ⅱ. ![]() ;
;
Ⅲ. ![]() 。
。
(1)A中含有的官能团的结构简式为____。B的名称为____。
(2)F的结构简式为____________。N中含氧官能团的名称为________。
(3)I的核磁共振氢谱有____组吸收峰。G分子最多有______个原子共平面。
(4)同时满足下列条件的J的同分异构体有_________种。
①苯环上连有两个取代基 ②1mol该物质于足量的NaHCO3反应,生成2molCO2
(5)参照上述信息和合成路线,以![]() 为起始原料(其他无机试剂任选),补充完整制备
为起始原料(其他无机试剂任选),补充完整制备![]() 的合成路线:___________________
的合成路线:___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知:
①![]() (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)
②![]()
下面是PAS—Na的一种合成路线(部分反应的条件未注明):

按要求回答问题:
(写)出下列反应的化学方程式并配平
A→B:_______________________;
B→C7H6BrNO2:______________________;
(2)出下列物质的结构简式:C:____________________
D:______________________;
(3)出反应类型:II_______________,
(4)D→ E (反应III)所需条件_____________;
(5)写出C到D的化学反应方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铁组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L,下列推断中错误的是
A. 参加反应的镁、铁共0.2 mol
B. 参加反应的盐酸为0.2 mol
C. 镁、铁在反应中共失去电子0.4 mol
D. 若与足量的稀硫酸反应能产生氢气0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50.0mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀盐酸处理后沉淀量减少到4.66g,并有气体放出。试计算∶
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度分别是多少?__________、_________________1.0 mol/L 0.4 mol/L
(2)产生的气体在标准状况下的体积。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有特殊功能高分子材料的开发和利用,越来越成为科学家研究的方向。下图是合成具有特殊功能高分子材料W的流程:

已知:(R、R1、R2、R3代表烃基)

(1)反应①的反应类型是____________________。
(2)反应②是取代反应,其化学方程式是____________________。
(3)D的核磁共振氢谱中有两组峰且面积之比是1:3,不存在顺反异构。D的结构简式是_______________;分子式符合C4H8,属于烯烃的同分异构体共有__________种(含顺反异构)。
(4)反应⑤的化学方程式是____________________。
(5)G的结构简式是____________________。
(6)反应⑥的化学方程式是____________________。
(7)工业上也可用 合成E。____________________由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,
合成E。____________________由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,  不易发生取代反应)。
不易发生取代反应)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)锌锰(Zn—MnO2)干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
①该电池的负极材料是_________。电池工作时,电子流向_____________(填“正极”或“负极”)。
②若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________________________。
(2)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。该电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
①该蓄电池放电时,电解质溶液中阴离子移向_____________(填“正极”或“负极”);正极附近溶液的酸性_____________(填“增强”、“减弱”或“不变”)放电时,负极的电极反应式为:_____________________________(用离子方程式表示)。(已知:硫酸铅为不溶于水的白色沉淀,生成时附着在电极上)
②实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得0.050 mol Cl2,这时电池内消耗的H2SO4的物质的量至少是________________。氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为___________________。该电池工作时,外电路每流过2 mol e-,消耗标况下氧气_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
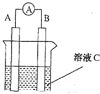
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32-4e-=4CO2,正极反应式为________________________,电池总反应式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com